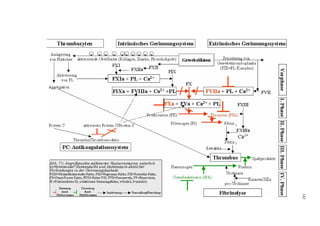
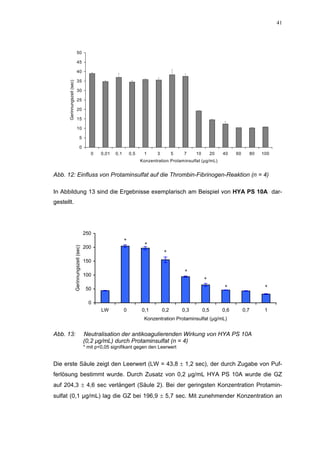
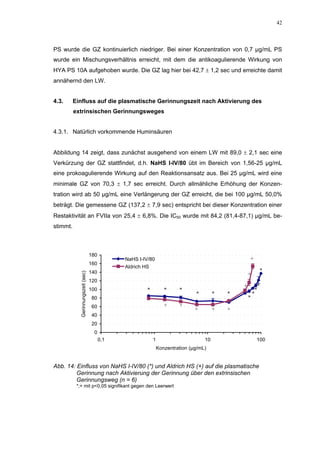
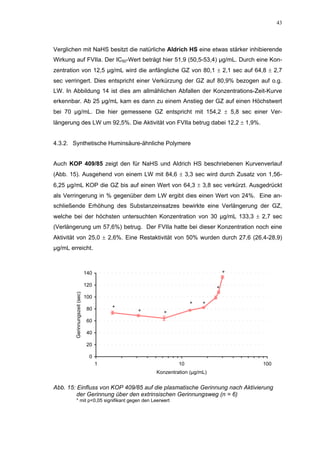
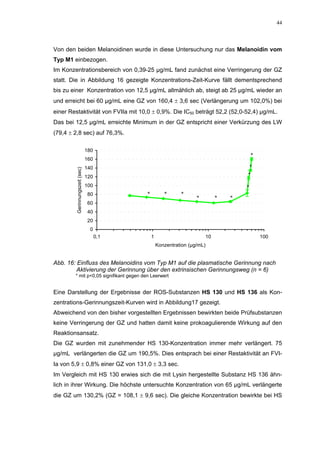
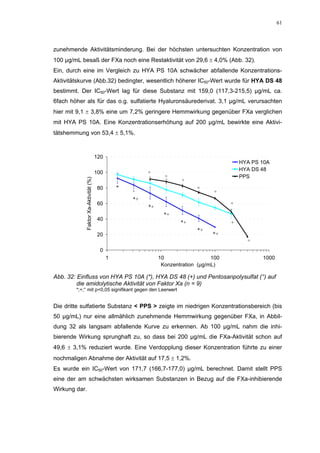
Die Dissertation untersucht den Einfluss von sulfatierten Hyaluronsäuren, natürlichen und synthetischen Huminsäuren auf das Gerinnungssystem in vitro. Zentrale Aspekte sind die antikoagulierenden Eigenschaften dieser Verbindungen sowie deren potenzielle Biokompatibilität. Die Forschung hinterfragt auch die thrombogenen Risiken im Zusammenhang mit natürlichen Huminsäuren und deren Ähnlichkeit zu schädlichen Substanzen.
![Einfluss von sulfatierten Hyaluronsäuren, natürlichen Huminsäuren und
synthetischen Huminsäure-ähnlichen Polymeren auf das Gerinnungssystem
in vitro
Dissertation
zur Erlangung des akademischen Grades
doctor rerum naturalium (Dr. rer. nat.)
vorgelegt der
Mathematisch-Naturwissenschaftlich-Technischen Fakultät
(mathematisch-naturwissenschaftlicher Bereich)
der Martin-Luther-Universität Halle-Wittenberg
von Frau Nicolle Mahr
geb. am: 07.11.1974 in: Sonneberg
Gutachterin bzw. Gutachter:
1. Priv.-Doz. Dr. habil. E. Krause
2. Prof. Dr. rer. nat. Dr. med. habil. H.-P. Klöcking
3. Prof. Dr. med. habil. G. Vogel
Halle (Saale), den 23. September 2003
urn:nbn:de:gbv:3-000005714
[http://nbn-resolving.de/urn/resolver.pl?urn=nbn%3Ade%3Agbv%3A3-000005714]](https://image.slidesharecdn.com/prom-110223214034-phpapp02/75/Prom-1-2048.jpg)














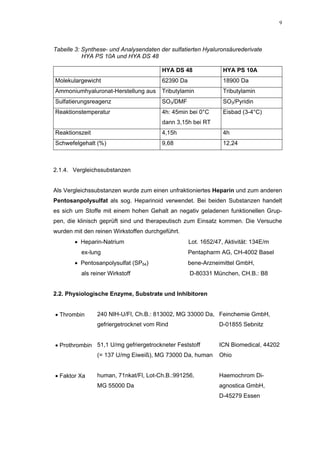











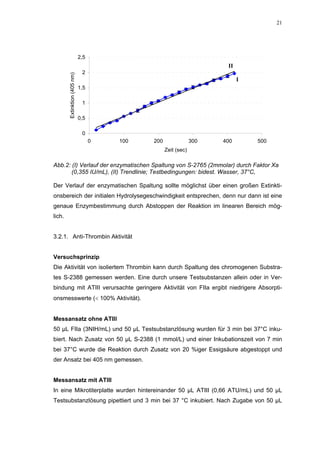













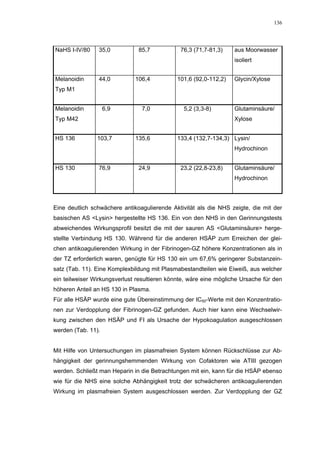
![65
100
90 H S 130
Faktor Xa-Aktivität (%)
80 H S 136
70
60
50
100 40
* 30
20
90 * 10
* * 0
80 *
1 10 100 1000
Faktor Xa-Aktivität (%)
K o n z e n tra tio n (µ g /m L )
* Abb. 31
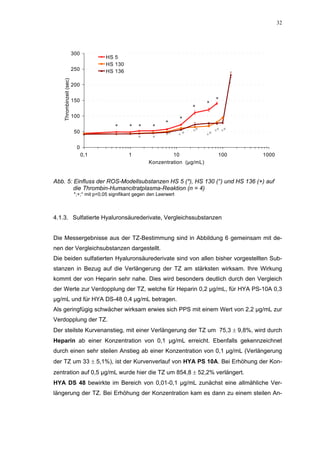
70
+ +
60 + +
+
50 * +
+
40
+
30
20 HS 130
10 HS 136
0
0,1 1 10 100 1000
Konzentration (µg/mL)
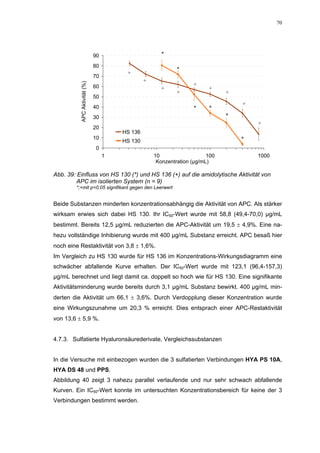
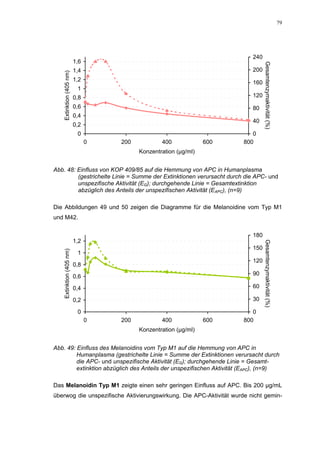
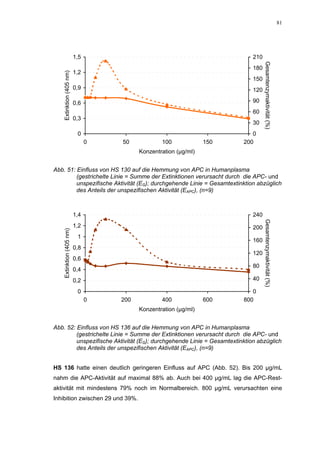
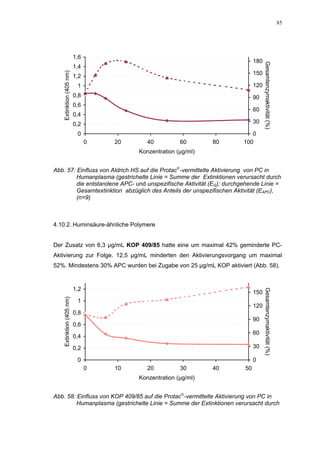
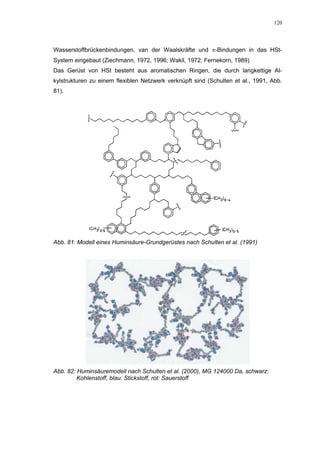
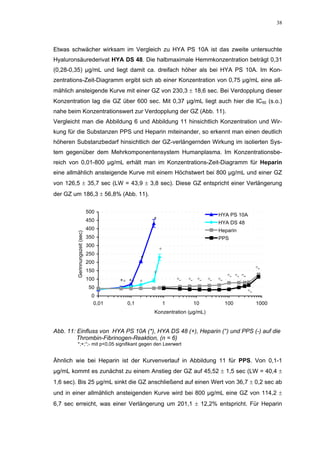
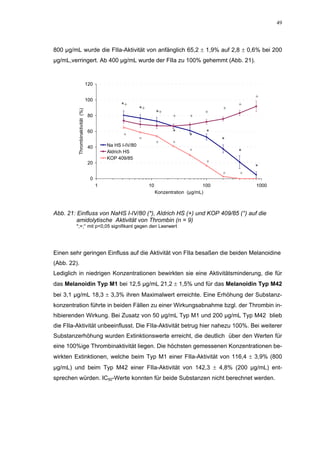
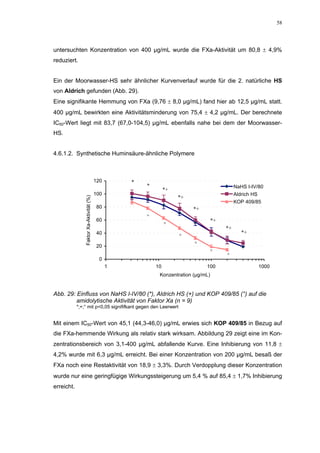
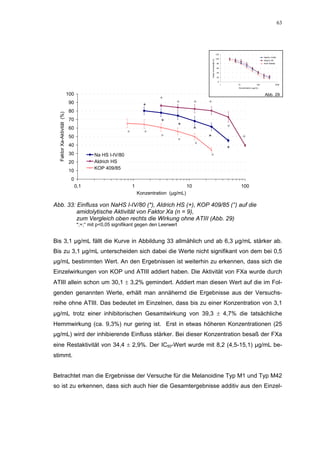
Abb. 35: Einfluss der ROS-Substanzen HS 130 (*) und HS 136 (+) auf die
amidolytische Aktivität von Faktor Xa (n = 9),
zum Vergleich oben rechts die Wirkung ohne ATIII (Abb. 31)
*;+ mit p<0,05 signifikant gegen den Leerwert
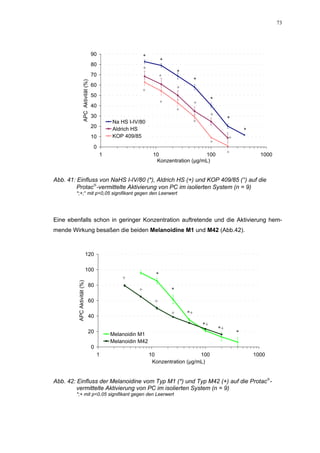
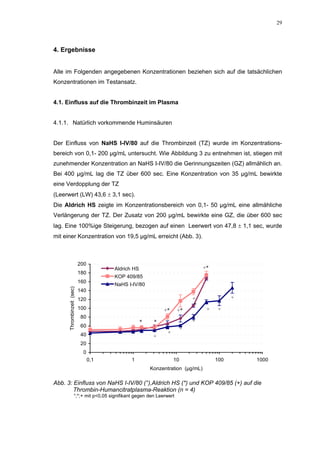
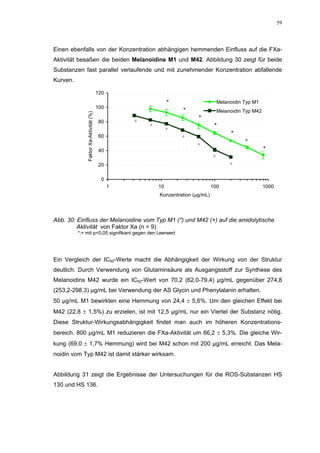
Für HS 130 konnte, wie für die anderen Huminsäure-ähnlichen Polymere auch, keine
Wirkungsverstärkung durch Zusatz von ATIII erreicht werden. Unter Zusatz von ATIII
allein wurde der FXa um 9,0 ± 0,1% in seiner Aktivität gehemmt. Die in Abbildung 35
dargestellten Ergebnisse setzten sich auch hier additiv aus den Einzel-Inhibierungs-
werten zusammen. Ähnlich wie bei den anderen untersuchten Huminsäure-ähnlichen
Substanzen stellt sich hier der Kurvenverlauf in Abbildung 35 dar. Bis 25 µg/mL bewir-
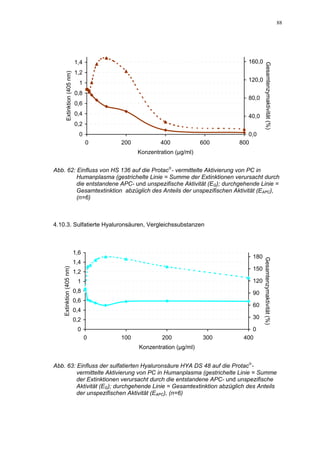
kte die Verdopplung der Konzentration ausgehend von 0,8 µg/mL nur einen geringen
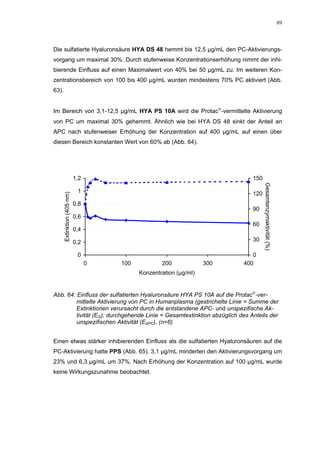
Anstieg der hemmenden Wirkung. Durch weitere Konzentrationserhöhung kommt es
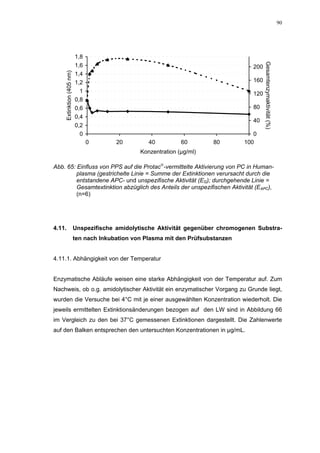
dann zu einem stärkeren Abfall der Kurve, so dass bei 100 µg/mL eine Inhibierung von
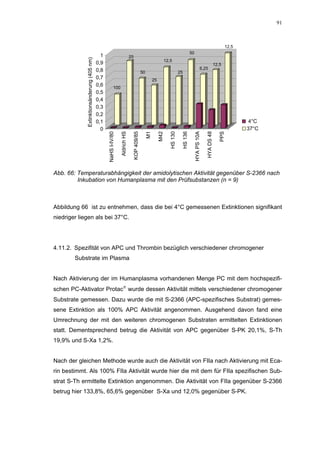
57,2 ± 2,2% verursacht wird. Der bestimmte IC50-Wert liegt mit 78,1 (73,8-82,7) µg/mL
im Bereich des im ATIII-freien System bestimmten.
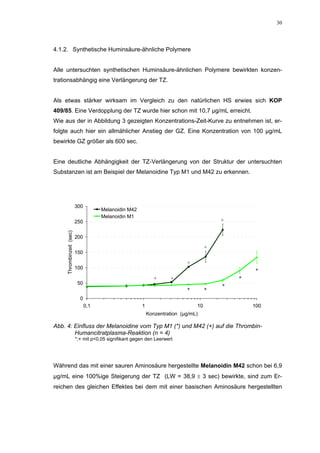
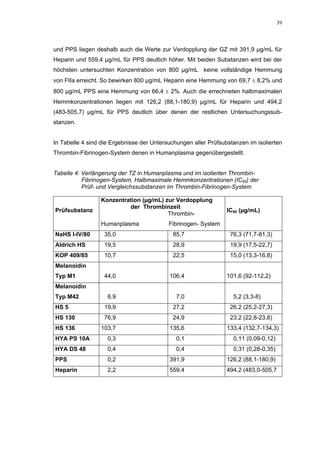
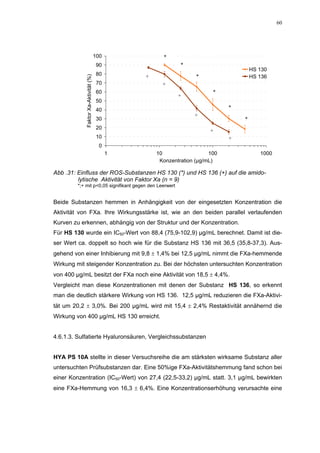
Ein etwas anderes Ergebnis wurde für die zweite ROS-Modellsubstanz HS 136 er-
halten. Der Zusatz von ATIII verursachte hier eine Wirkungsverminderung, die am
deutlichsten durch den Vergleich der IC50-Werte zu erkennen ist [36,5 (35,8-37,3)
µg/mL ATIII-freies System; 426,7(382,2-476,3) µg/mL unter Zusatz von ATIII]. Der hier
bestimmte Wert liegt ca. 12x höher. Relativ stark sind dabei die Messwerte im höheren
Konzentrationsbereiches (ab 50 µg/mL) betroffen. 200 µg/mL reduzierten die FXa-
Aktivität um 41,1 ± 2,3%. Damit liegt dieser Wert um die Hälfte niedriger als der ent-
sprechende im ATIII-freien System. Die höchste untersuchte Konzentration von 800](https://image.slidesharecdn.com/prom-110223214034-phpapp02/85/Prom-73-320.jpg)