09 aminas 2012
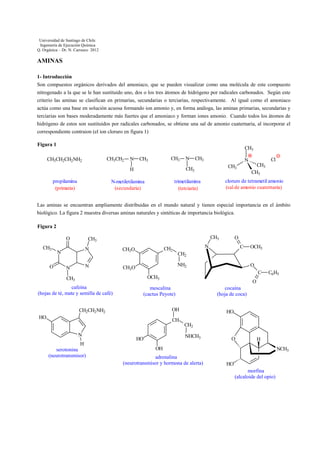
- 1. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 AMINAS 1- Introducción Son compuestos orgánicos derivados del amoniaco, que se pueden visualizar como una molécula de este compuesto nitrogenado a la que se le han sustituido uno, dos o los tres átomos de hidrógeno por radicales carbonados. Según este criterio las aminas se clasifican en primarias, secundarias o terciarias, respectivamente. Al igual como el amoniaco actúa como una base en solución acuosa formando ion amonio y, en forma análoga, las aminas primarias, secundarias y terciarias son bases moderadamente más fuertes que el amoniaco y forman iones amonio. Cuando todos los átomos de hidrógeno de estos son sustituidos por radicales carbonados, se obtiene una sal de amonio cuaternaria, al incorporar el correspondiente contraion (el ion cloruro en figura 1) Figura 1 CH3 CH3CH2 CH3CH2CH2NH2 N CH3 CH3 CH3 CH3 CH3 CH3 cloruro de tetrametil amonio (sal de amonio cuaternaria) trimetilamina (terciaria) N-metiletilamina (secundaria) Cl N CH3 H propilamina (primaria) N Las aminas se encuentran ampliamente distribuidas en el mundo natural y tienen especial importancia en el ámbito biológico. La figura 2 muestra diversas aminas naturales y sintéticas de importancia biológica. Figura 2 O CH3 O CH3 CH3 N N N N CH2 CH3O O N C NH2 CH3O O C OCH3 CH3 cafeína (hojas de té, mate y semilla de café) OCH3 CH2 O mescalina (cactus Peyote) cocaína (hoja de coca) OH CH2CH2NH2 HO C6H5 HO CH CH2 N H serotonina (neurotransmisor) NHCH3 HO O H OH adrenalina (neurotransmisor y hormona de alerta) NCH3 HO morfina (alcaloide del opio)
- 2. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 CH3 Figura 2 (continuación) O CF3 N NHCH3 O N Cl diazepam fluoxetina o Prozac (antidepresivo) C6H5 2. Estructura y propiedades físicas Al igual que el amoniaco, las aminas alifáticas tienen una geometría aproximadamente tetraédrica. En el amoniaco, el ángulo H-N-H es de 107 º, mientras en estas aminas los ángulos H-N-H, H-N-C y C-N-C aumentan levemente en función del volumen de los grupos alquilo que las presentes. La figura muestra uno de los orbitales moleculares del amoniaco en que se observa en rojo la zona ocupada por el par electrónico no compartido y de qué modo éste influye en la estructura y propiedades de las aminas. La tabla 1 muestra una comparación de las propiedades físicas de algunas aminas, alcanos y alcoholes de pesos moleculares comparables. En ella se observa que las aminas poseen puntos de ebullición significativamente mayores que los alcanos, pero, inferiores que los de alcoholes. Tabla 1 PM [g/mol] p.e., ºC PM [g/mol] p.e., ºC CH3CH3 30 -88,6 CH3CH2CH3 44 -42,1 CH3NH2 31 -6,3 CH3CH2NH2 45 16,6 CH3OH 32 65,0 CH3CH2OH 46 78,5 CH3 CH3 compuesto compuesto Figura 3 CH3CH2CH2 N H propanamina p.e. 48ºC H CH3CH2 N H N-metiletanamina p.e. 37ºC N CH3 CH3 N,N-dimetilmetanamina p.e. 3ºC Las aminas primarias y secundarias, al igual que los alcoholes pueden formar puentes de hidrógeno intermoleculares en el líquido puro, mientras los alcanos no tienen esta capacidad. Esta fuerza de asociación explica el orden de los puntos de ebullición. La existencia de esta fuerza explica a su vez la diferencia de puntos de ebullición de las aminas isómeras de la figura 3. Por su parte, la solubilidad en agua sigue la misma tendencia que la que presentan los alcoholes en el sentido que las aminas de hasta 4 átomos de carbono son miscibles con agua, observándose una rápida disminución de la solubilidad al aumentar la cadena carbonada. La solubilidad de las aminas de bajo peso molecular se debe fundamentalmente a la capacidad de éstas de formar puentes hidrógeno con el agua.
- 3. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Ejercicio Haga una representación gráfica que muestre los puentes hidrógeno formados (a) en la butanamina pura; (b) en una solución acuosa de trimetilamina 3. Preparación de aminas A nivel industrial la producción de metilaminas y de anilina son las de mayor importancia. Con una producción mundial que alcanza a aproximadamente 1,0 · 106 toneladas/año, en el caso de las metilaminas, la reacción se lleva a cabo tratando metanol con amoniaco, con catálisis de óxido de aluminio, según la reacción: CH3OH + Al2O3 · SiO2 NH3 CH3NH2 350 - 500ºC; 20-30 bar + (CH3)2NH + (CH3)3N + H2O Este es un proceso específico para la obtención de metilaminas y aA estas temperaturas se alcanzan condiciones de equilibrio en las que se obtiene una mezcla de las tres metilaminas. Por ejemplo, a 500ºC y usando una razón amoniaco/metanol = 2,4 : 1 se obtiene un 56% de metilamina, 26% de dimetilamina y 20% de trimetilamina, con un 94% de selectividad hacia la formación de metilaminas. (a) Sustitución nucleofílica de haluros de alquilo. H Figura 4 CH3CH2CH2CH2 Br + NH3 AN CH3CH2CH2CH2 N H + Br H ion butilamonio nucleofilo sustrato Si el nucleófilo está en exceso, puede actuar como base neutralizando el ion amonio, lo que genera la amina primaria como producto. En cambio, cuando el nucleófilo no está en exceso, la amina primaria obtenida puede actuar como nucleófilo y producir una amina secundaria (ver figura 5). H Figura 5 CH3CH2CH2CH2 N H + NH3 A-B CH3CH2CH2CH2 N H + NH4 H amina primaria H producto principal Este ciclo se puede repetir hasta obtener la sal de amonio cuaternaria como muestra la figura 6. En estas condiciones se obtiene una mezcla de aminas primaria, secundaria, terciaria y eventualmente la sal de amonio cuaternaria. H Figura 6 CH3CH2CH2CH2 Br CH2CH2CH2CH3 CH2CH2CH2CH3 CH3CH2CH2CH2 N CH2CH2CH2CH3 + CH3CH2CH2CH2Br Amina 2ª CH2CH2CH2CH3 CH3CH2CHCH2 N bromuro de tetrabutilamonio (sal de amonio cuaternaria) Br + CH3CH2CH2CH2NH2 +CH3CH2CH2CH2Br CH2CH2CH2CH3 CH3CH2CH2CH2 N Amina 3ª CH2CH2CH2CH3
- 4. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Figura 6 (continuación) NHCH3 + CH3 nucleofilo I N(CH3)2 sustrato + CH3I N(CH3)3 I nucleofilo no nucleofilo (b) Reducción de nitrocompuestos A escala de laboratorio e inicialmente también a nivel industrial la reducción del grupo nitro se realiza con metales tales como Sn, Fe y Al como agentes reductores, ya que en presencia de ácido generan hidrógeno (H2). A nivel industrial, actualmente la anilina se produce en un volumen superior a los 3 millones de toneladas. Se obtiene preferentemente por hidrogenación catalítica en procesos en fase líquida y gaseosa, como el proceso que desarrolla las BASF descrito en la figura 7. H Figura 7 Cl NH2 N NO2 H NaOH H Fe / HCl + NaCl H2O sal de amonio H2 (exceso 9 : 1) / Cu / SiO2; 270 -290ºC; 1 - 5 bar (c) Reducción de nitrilos A escala de laboratorio, la reducción de nitrilos puede realizarse utilizando hidruros tales como LiAlH4 en éter etílico como solvente. A nivel industrial, el método preferido es la hidrogenación catalítica como muestra la figura 8 Figura 8 N C CH2CH2CH2CH2 C adiponitrilo N + 4 H2 1) Ni Raney (cat.) / CH3CO2Na 50ªC; 50 psi, 45-60 min. 2) NaOH / H2O H2N CH2CH2CH2CH2CH2CH2 NH2 hexametilendiamina (100%) 4-Reacciones 4.1. Basicidad Al igual que el amoniaco, en solución acuosa, las aminas se comportan como bases y sus equilibrios ácido-base se pueden describir mediante las ecuaciones indicadas en la figura 9. Figura 9 CH3CH2NH2 + H2O CH3CH2NH3 CH3CH2NH3 + H2O CH3CH2NH2 + + HO H3O Kb = Ka = [CH3CH2NH3] [HO ] [CH3CH2NH2] [CH3CH2NH2] [H3O ] [CH3CH2NH3] Ambos equilibrios describen la misma propiedad y en solución acuosa están relacionados mediante la constante de autoionización del agua, Kw, que regula la relación entre la [H3O+] y [HO-], de modo que: Ka · Kb = 1,0 · 10-14 = Kw (en agua a 25º C) (1/Ka) · (1/Kb) = 1/ 1,0 · 10-14 Tomando logaritmos, se obtiene: log 1/Ka + log 1/Kb = pKa + pKb = 14,00
- 5. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Las ecuaciones anteriores demuestran que las constantes Ka y Kb no son independientes entre sí, sino, que el valor de una determina el valor de la otra. Por este motivo, son los valores de Ka los que se encuentran habitualmente tabulados, sin embargo, debe recordarse que estos se refieren al ion amonio. La tabla 2 muestra valores de pKa de los iones amonio (y los correspondientes valores de pKb de las aminas). Tabla 2: Valores de pKa para el equilibrio RNH3+ + H2O ion amonio pKa Ka CH3NH3+ 10,657 2,70 ·10-11 (CH3)2NH2+ 10,732 1,85 · 10-11 10,66 RNH2 + H3O+ (en agua a 25ºC) 2,19 · 10-11 NH3 + (CH3)2NH 3,228 3,34 8,92 CH33 CH 4,73 NH3 3,343 8,32 · 10-6 NH3+ CH3 CH3NH2 NH2 5,08 NH22 NH 1,86 · 10-5 9,27 + NH2 CH3 CH3 4,63 NH3 -5 2,34 · 10 9,37 + NH2 3,46 NH3 3,47 · 10-4 10,54 NH2 + Cl Cl 4,15 7,08 · 10-5 NH3+ Cl NH3 9,85 Cl 2,466 NH2 3,42 · 10-3 11,533 + NH2 O2N O2N 6,953 1,11 · 10-7 7,047 NH NH H a pKba base N Valores de pKb para el equilibrio RNH2 + H2O N RNH3+ + HO-
- 6. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Como se puede observar, las aminas alifáticas tienen pKa ~ 10-11 (Ka ~ 10-10 a 10-11 pKb ~3-4 Kb ~ 10-3 a 10-4). Por su parte, las aminas aromáticas tienen pKa ~ 5 y con sustituyentes electroatrayentes pueden llegar a pKa = 1,0 (p.ej. p-nitroanilina) Figura 10 O2N NH3 O2N + H2O NH2 + H3O (Ka = 1,0· 10-1) 4.2 Acidez de aminas Las aminas pueden actuar como ácido, pero, son ácidos extremadamente débiles y esta propiedad se presenta en medio no acuoso, como muestra la figura 11 Figura 11 o NH3(l) + Na (s) NH3 líquido <0º Na NH2 + 1/ H2 (g) 2 sodamida - El ion NH2 generado en la solución de amoniaco líquido es una base extremadamente fuerte, ya que deriva de un ácido muy débil (NH3 tiene Ka ~ 10-35). La reacción ácido-base también puede tener lugar con otras bases ver (figura 12): Figura 12 H + CH(CH3)2 + CH3CH2CH2CH2 Li diisopropilamina butil litio (base 1) (ácido 1) (CH3)2CH N benceno (CH3)2CH N CH(CH3)2 Li + diisopropilamida de litio (LDA, base 2) C4H10 butano (ácido 2) Esta base ha sido utilizada con singular éxito en reacciones de síntesis ya que, a diferencia del ion amiduro (NH2-), es igualmente fuerte como base, pero, su mayor volumen la hace inerte como nucleófilo. 4.3. Formación de amidas La formación de amidas tiene lugar por reacción directa entre un ácido carboxílico y amoniaco, una amina primaria o secundaria (pero no terciaria). Sin embargo, inicialmente se produce una reacción ácido-base que da lugar a la formación de una sal de amonio, como muestra la figura 13. Figura 13 CH3COH + ácido O O O CH3C O NH4 sal NH3 base CH3C NH2 + H2O (g) O O C > 200 º OH C N + (CH3CH2)2NH > 200 º CH2CH3 CH2CH3 También se pueden forman por reacción con cloruros de ácido o con anhídridos (ver figura 14).
- 7. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 H Figura 14 NH2 O + N O CH3C O C CCH3 O + O anhídrido acético anilina CH3 CH3C OH acetanilida O O C C Cl N(CH2CH3)2 + HCl N + (CH3CH2)2NH cloruro de benzoílo N,N-dietilbenzamida N + H N Cl H + Cl piridina En el segundo ejemplo, la piridina (p.e. 100º) actúa como solvente y base, capturando el ácido formado (3ª ecuación) La amina puede regenerarse posteriormente mediante una hidrólisis ácida o básica de la amida (figura 15). El mecanismo de formación e hidrólisis de amidas se estudiará con mayor detención en el capítulo de ácidos carboxílicos. Figura 15 H N C NH2 CH3 + H2O O NaOH / H2O + 100ºC CH3CO2H acetanilida 4.4. Formación de sales de diazonio La reacción de aminas con ácido nitroso (HNO2) da lugar a dos tipos de productos. Con aminas primarias se obtiene una sal de diazonio, mientras que con una amina secundaria se forman N-nitrosaminas, como muestra la figura 16. Las aminas terciarias no dan reacción con HNO2. Figura 16 NH2 N N Cl NaNO2 HCl , 0º cloruro de bencendiazonio CH3 NHCH3 N N KNO2 H2SO4 N-nitroso-N-metilanilina O
- 8. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 El ácido nitroso es un ácido débil (pKa = 3,35) que se descompone rápidamente en solución acuosa de acuerdo a la ecuación: 2 HNO2 NO + NO2 + H2O Por esta razón que habitualmente se lo prepara “in situ” (de latín en el mismo sitio y en química significa además, en el momento) a partir de un nitrito alcalino y un ácido fuerte: NaNO2 (s) + HCl (ac) KNO2 (s) + H2SO4 (ac) HNO2 (ac) + HNO2 (ac) + Na+(ac) K+(ac) + Cl-(ac) + HSO4-(ac) Las sales de diazonio se preparan en solución acuosa y aquéllas de aminas alifáticas se descomponen espontáneamente para dar alcohol. Sólo las sales de diazonio de aminas aromáticas son suficientemente estables como para cristalizarlas y usarlas a baja temperatura (i.e. 0 a 5ºC) como intermediarios de síntesis en sustitución nucleofílica aromática y en reacciones de síntesis de colorantes azoicos. (SEA). La figura 17 muestra el ámbito de la sustitución nucleofílica aromática (SNA) sobre sales de diazonio. Cl Figura 17 Cu2Cl2 + N2 + N2 Br Cu 2Br2 I KI N N Cl + N2 F HBF4 estable en solución acuosa ácida a 0 ºC + + C Cu2(CN)2 KCN N2 N2 N OH 25 º + N2 + N2 H H3PO2 Como se puede apreciar, las sales de diazonio permiten la introducción de sustituyentes en el anillo bencénico, tales como OH, I, F y CN, imposibles de incorporar mediante reacciones de sustitución electrofílica aromática. Un ejemplo de estas reacciones de sustitución se muestra en la figura 18. Cabe hacer presente que, por cuanto cloro y bromo son orientadores orto-para, no es posible obtener el producto final por halogenación directa.
- 9. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Figura 18 NO2 NO2 + Br2 NH2 1)Sn, HCl Fe, Br2 140ºC; 4 hrs. Cl N2Cl NaNO2 HCl, 0º 2) NaOH(ac) Br Br CuCl HCl, 0º Br Br Además, las sales de diazonio permiten la síntesis de colorantes azoicos en una reacción en que el ion bencendiazonio actúa como electrófilo, E+, para atacar a un sustrato aromático en una reacción conocida como copulación. Sin embargo, esta reacción requiere que el sustrato esté muy activado hacia la SEA por lo que sólo ocurre normalmente cuando el sustrato es un fenol, una anilina o un derivado alquilado de estos. La figura 19 ilustra la síntesis de laboratorio de 1-fenilazo-2-naftol, un colorante azoico. Figura 19 N N N N Cl OH OH + cloruro de bencendiazonio (incoloro) -naftol (incoloro) 1-fenilazo-2-naftol Sudan I o Solvent Yellow 14 (C.I. 12055; un colorante azoico) Estos compuestos actúan como colorantes ya que absorben luz de la región visible del espectro luminoso (absorben luz azul y lucen de color anaranjado), debido a que la reacción genera una conjugación más extendida en el colorante, en comparación a la existente en los reactivos que son incoloros (ya que su espectro de absorción cae en la región UV y no es visible al ojo humano). Cabe señalar que es posible formar el colorante de dos modos, según la molécula en la que se coloca el grupo diazonio, sin embargo, de acuerdo a lo indicado anteriormente, dicha molécula (el electrófilo) sólo reacciona con rendimientos aceptables con sustratos unidos a sustituyentes fuertemente electrodonantes. Figura 20 N2Cl OH + N2Cl 1-fenilazo-2-naftol OH + Lectura adicional Reusch, W., http://www.cem.msu.edu/~reusch/VirtualText/amine1.htm#aminom (rev. 16-06-07; consultado 3-08-09). March, J. y Smith, M.B., Advanced Organic Chemistry, 6ª ed., editorial Wiley-Interscience, 2007, pág. 918. Coxon, J.M. y Gerrard, J.A., Worked Solutions in Organic Chemistry, editorial Blackie Academic and Professional, 1998, pág. 219.
- 10. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 Problemas propuestos 1. Escriba estructuras y dé nombre IUPAC, para todos los isómeros posibles de las siguientes fórmulas moleculares. Rotule cada isómero con una letra y ponga ejemplos de cada tipo de isomería presente. (a) C5H13N (b) C4H11N 2. (a) Compare las propiedades físicas de las aminas con las de alcanos y alcoholes de peso molecular comparable (ver algún texto). Justifique sus observaciones. (b) Qué valor esperaría usted para el p.e. de la trimetilamina, en comparación con la propanamina? Busque los valores en un texto y justifique haciendo un diagrama de las fuerza presentes en uno y otro caso. 3. Proponga un método de preparación de las siguientes aminas, a partir del compuesto entre paréntesis (a) (b) (c) (d) (e) anilina (benceno) 1-butanamina (1-butanol) 2-feniletilamina (2-feniletanonitrilo) N-metilanilina (nitrobenceno) ciclopentilmetanamina (bromociclopentano) 4. Escriba las 2 ecuaciones que ilustran las propiedades ácido-base de la anilina en agua a 25ºC. Al respecto, (a) Calcule el pH y la concentración de todas las especies en equilibrio de una solución formada al disolver 6,50 kg de cloruro de anilinio (una sal iónica) en estanque que contiene 15 m3 de agua. (b) Calcule el pH de la solución si se agrega 500 mL de HCl concentrado (37% p/p y d 1,19 g/mL) 5. Explique la tendencia de los valores de pKa de las siguientes familias de quinuclidinas: HO N pKa 11,3 Cl H N O H 9,9 N 8,9 H N H 7,2 6. Las aminas, al igual que el amoniaco, también pueden actuar como ácidos. Al respecto: (a) Escriba una ecuación que muestre cómo se forma el ion amida (NH2- o una sal de éste) (b) Usando la tabla de pKa entregada en clases, determine cual de los siguientes equilibrios estará desplazado hacia la derecha (i) 1-butino + Na+ NH2- CH3CH2CC- Na+ + NH3 (ii) benceno + LDA C6H5Li + diisopropilamina 7. Aplique 3 métodos a la preparación de las siguientes amidas. Dé nombre IUPAC a lo reactivos (a) N,N-dimetilbenzamida (b) N-metil-N-feniletanamida (c) N-fenilmetanamida 8. Plantee un mecanismo que explique cómo se forma una sal de diazonio, a partir de una amina primaria y ác. nitroso. En base a este mecanismo, indique por qué no se puede formar una sal de diazonio a partir de una amina secundaria.
- 11. Universidad de Santiago de Chile Ingeniería de Ejecución Química Q. Orgánica – Dr. N. Carrasco 2012 9. Proponga una secuencia de reacciones de síntesis de los siguientes compuestos, partiendo de material de partida indicado entre paréntesis (a) m-dibromobenceno (benceno) (b) p-iodotolueno (tolueno) (c) 1,3,5-tribromobenceno (anilina) (d) ác p-fluorbenzoico (benceno o tolueno) (e) 1,2,3-triclorobenceno (p-nitroanilina) 10. Proponga una síntesis para los siguientes colorantes azoicos, a partir de benceno, tolueno o 2-nitronaftaleno y, los reactivos inorgánicos y solventes de su elección. Examine en cada caso, las dos formas posibles de hacer reaccionar el electrófilo (la sal de diazonio) con el sustrato. (a) HO2C HO (b) N N N N (c) (CH3)2N NO2 OH N N SO3Na 11. Proponga una síntesis para las siguientes aminas, a partir del material de partida señalado entre paréntesis y reactivos inorgánicos y solventes de uso común en laboratorio (problema de integración de tópicos). (a) (b) (c) (d) ciclohexilamina (ciclohexano) 1-pentanamina (1-penteno) 1-octanamina (1-hepteno) cloruro de benzalconio (busque por benzalkonium chloride, escoja uno de la mezcla y prepárelo a partir de tolueno)
