Aгрегатно състояние на веществата
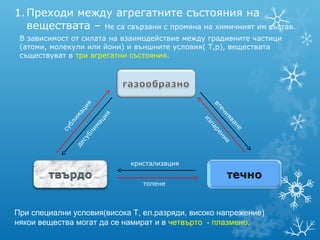
- 1. 1. Преходи между агрегатните състояния на веществата – Не са свързани с промяна на химичният им състав. В зависимост от силата на взаимодействие между градивните частици (атоми, молекули или йони) и външните условия( Т,р), веществата съществуват в три агрегатни състояния. я вт ци еч ма я ня ци и из ва бл ма па не су ли ре уб ни с е де кристализация топене При специални условия(висока Т, ел.разряди, високо напрежение) някои вещества могат да се намират и в четвърто - плазмено.
- 2. 2. Особености на твърдото агрегатно състояние на веществата. Най - малки разстояния между частиците. Най - големи сили на привличане между частиците. Частиците извършват само трептене и не се преместват в пространството. Твърдите вещества имат собствен обем, който слабо се обем влияе от Т и р. Градивните частици се подреждат по определен начин. В твърдите тела, се наблюдава по-голяма подреденост (далечен порядък ) и по-малка (близък порядък). порядък
- 3. 3. Аморфно състояние на веществата Разновидност на твърдото състояние. Има само близък порядък. порядък По строеж е по-близко до течностите. Частиците не са правилно подредени и не са свързани с еднакви по големина сили. Аморфните вещества нямат фиксирана Т0С на топене – топят се в широк температурен интервал. Първо омекват и постепенно се стапят. Имат изотропни свойства – свойствата им във всички посоки са еднакви. Неустойчиво състояние. Макар и много състояние бавно аморфните вещества преминават в кристално състояние. Двуизмерна проекция на аморфната структура на стъкло от силициев диоксид
- 4. Стъклата са хомогенни аморфни материали В лабораторията на Калифорнийският технологичен институт успешно е изпробван нов метод за обработка на заготовки от метално стъкло. Подобни материали, първите образци на които /сплав от Au75Si25 / се появиха през 1960 г., имат аморфна структура, която позволява да се комбинират, твърдостта на стъклото с издръжливостта на метала. APET = Аморфен Полиетилен Терефталат - формите за лед и шоколад са изработени от APET(Аморфен Полиетилен Терефталат). Това е разновидност на пластмаса, която се използва за торбички за печене, бутилки за мляко, тарелки за микровълнови и др. Този вид пластмаса е одобрена за ХВП и е напълно безвредна.
- 5. 4. Кристално състояние на веществата Кристал е твърдо тяло, ограничено от плоски стени, които сключват помежду си определени ъгли. По-стабилното състояние на твърдите вещества. Закономерно подреждане на градивните частици в пространството - далечен порядък. Образуват се пространствени кристални решетки. Едно и също вещество може да има повече от една кристална решетка. Най-малката част на кристалната решетка се нарича елементарна клетка. клетка Имат точно определена температура на топене. Имат анизотропни свойства – т.е. зависимост на някои физични и химични свойства от направлението на приложено външно въздействие.
- 6. Реални кристали – не притежават идеална структура характерна за монокристалите. Състоят се от множество по- малки кристалчета срастнати по между им. Дефекти в кристалната решетка – отклоненията от правилното пространствено разположение на частиците.
- 7. 5. Кристални решетки А) Елементарна клетка - най-малкият елемент от обема на пространствена кристална решетка. Характеристики: ръбове (а,b,c) и ъгли(α,β,γ). Най-простата кристална решетка е кубичната. Б) Свойствата на кристалните вещества зависят от: - вида на елементарната клетка; - вида на частиците; - силите, които действат между тях.
- 8. 6. Видове кристални решетки А) Йонна: - Вещества с йонна химична връзка; - Изградена е от катиони и аниони; - Може да се разглежда като огромна молекула; - Висока Т0т (от 3000С до 10000С); - Значителна твърдост, но са крехки; - Разтварят се в полярни разтворители; - Електропроводими в разтвор или стопилка. Примери: NaCl, KBr, CaF2, CuSO4 …
- 9. Б) Атомна: - изградена от атоми; - здрави ковалентни връзки; - кристала може да се разглежда като огромна молекула; - много висока Т0т (над 10000С); - голяма твърдост и крехкост; - диелектрици, а някои са полупроводници; - неразтворими в повечето разтворители. Примери: С, В, Si, SiO2, SiC …
- 10. В) Молекулна: - изградена от полярни или неполярни молекули; - слаби междумолекулни сили; - ниска Т0т (под 3000С); - малка твърдост; - крехкост; - диелектрици; - разтворими в различни разтворители (по правилото”подобни се разтварят в подобни”). Примери: I2, P4, S8, SO3, С60, лед ...
- 11. Г) Метална: - положителни йони и електронен газ; - метална връзка; - общи свойства на металите – блясък, ковкост, топло- и електропроводимост...; - Т0т в широки граници(от -340С при Hg до 33800С при W); - твърдост в широки граници; - плътност в широки граници (от ρ= 0,534g/sm3 –Li до ρ= 22,57g/sm3 – + + + + Os); + + + + Примери: Fe, Cu, Zn, Na, AI … + + + +
- 12. ТО ! АН ИЕ ВН ИМ ЗА ДА РЯ ЛАГО Б
