Gases reales
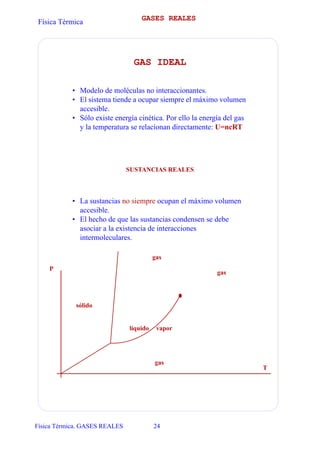
- 1. Física Térmica Física Térmica. GASES REALES 24 GASES REALES GAS IDEAL • Modelo de moléculas no interaccionantes. • El sistema tiende a ocupar siempre el máximo volumen accesible. • Sólo existe energía cinética. Por ello la energía del gas y la temperatura se relacionan directamente: U=ncRT SUSTANCIAS REALES • La sustancias no siempre ocupan el máximo volumen accesible. • El hecho de que las sustancias condensen se debe asociar a la existencia de interacciones intermoleculares. gas vaporlíquido gas gas sólido P T
- 2. Física Térmica Física Térmica. GASES REALES 25 HIPÓTESIS DE VAN DER WAALS (1872) 1 Las moléculas tienen un volumen finito rm potencial repulsivo para r<rm r V(r) rm p ( v - b ) = R T covolumen
- 3. Física Térmica Física Térmica. GASES REALES 26 HIPÓTESIS DE VAN DER WAALS (1872) 2 Las moléculas se atraen a distancias muy grandes La fuerza atractiva hace que: • Las moléculas se frenen a larga distancia cuando se dirigen hacia la pared • Las moléculas intercambien menos momento lineal cuando chocan con las paredes. Por lo tanto la presión que ejercen sobre las paredes se reduce. La fuerza atractiva que siente una molécula es proporcional al número de moléculas restantes N-1. La fuerza atractiva que se siente en todos el gas es proporcional a la fuerza que se ejerce sobre cada una de las partículas. Es decir N(N-1). Aproximadamente N2 r V(r) ε rm p RT v b– ----------- a v 2 -----–=
- 4. Física Térmica Física Térmica. GASES REALES 27 r V(r) DOS SITUACIONES MUY DIFERENTES energía del sistema r V(r) energía del sistema
- 5. Física Térmica Física Térmica. GASES REALES 28 Existe una condición, relacionada con la energía del sistema que determina si es posible o no la condensación. Punto crítico: punto del diagrama p,T que señala la temperatura y presión máxima a la que puede condensar una sustancia. Densidad crítica: Valor de la densidad en el punto crítico. ISOTERMAS DE VAN DER WAALS
- 6. Física Térmica Física Térmica. GASES REALES 29 Gas de van der Waals RTc 8 27 ------ a b ---= pc 1 27 ------ a b2 -----= vc 3b= PUNTO CRÍTICO f p v T, ,( ) 0= v∂ ∂p T 0= v 2 2 ∂ ∂ p T 0= ENERGÍA DEL GAS DE VAN DER WAALS v∂ ∂cv T T T 2 2 ∂ ∂ p v cte= = v∂ ∂u T p T⁄( )∂ 1 T⁄( )∂ ------------------ v – a v2 -----= = u cRT a v ---–= uc a 3b ------ 8 9 ---c 1– = término cinético término potencial
- 7. Física Térmica Física Térmica. GASES REALES 30 ECUACIONES DESCRIPTIVAS DE UN GAS REAL NOMBRE ECUACIÓN PARÁMETROS AJUSTABLES Gas ideal 1 van der Waals 3 Desarrollo del virial ilimitado ilimitado Dietereci 3 Beattie- Bridgeman 6 Benedict- Webb-Rubin 9 pv RT= p a v2 -----+ v b–( ) RT= pv RT B T( )p C' T( )p2 …+ + += pv RT 1 B T( ) v ------------ C T( ) v2 ------------ …+ + + = p RT v b– -----------e a RTv ----------– = p RT 1 ε–( ) v2 ------------------------ v B+( ) A v2 -----–= A A0 1 a v ---– = B B0 1 b v ---– = ε c vT3 ---------= p Tψ φ– Γ T2 ------–= ψ Rρ 1 B0ρ bρ2+ +( )= φ Aρ2 aρ3 αaρ6–+= Γ Cρ2 cρ3 1 γρ2+( )e γρ2––= ρ 1 v ---=
- 8. Física Térmica Física Térmica. GASES REALES 31 DESARROLLO DEL VIRIAL • La idea es que una ecuación de estado es de la forma p=p(v,T) o v=v(p,T). • Sabiendo que en el límite de presiónes bajas o volúmenes altos se cumple la ecuación del gas ideal se busca un desarrollo en serie de potencias que cumpla esta condición. • Implica una descripción exacta de la ecuación térmica de estado de un gas real... siempre que se conozcan los infinitos términos del desarrollo. • Es un desarrollo en serie de potencias no ortogonal. Esto implica que experimentalmente es difícil determinal los coeficientes porque dependen del número de coeficientes que se pretentan determinar. • Toda ecuación de estado puede escribirse como un desarrollo en serie de potencias en la presión o en el volumen. • Los coeficientes del virial del desarrollo en presión o en volumen son, en general, diferentes. Si se escriben de la forma expresada arriba el segundo coeficiente es el mismo para los dos desarrollos. • Para determinar, experiementalmente, los coeficientes se calculan las funciones de desviación: para el desarrollo en volumen y y se representan frente a v o p respectivamente. La ordenada da el segundo coeficiente y la pendiente el tercer coeficiente. El ruido experimental es muy alto. p RT v ------- 1 B v --- C v2 ----- …+ + + = v RT p ------- B C'p …+ + += ∆ pv RT ------- 1– v= α v RT p -------–=
- 9. Física Térmica Física Térmica. GASES REALES 32 SEGUNDO COEFICIENTE DEL VIRIAL • Es el coeficiente más importante porque representa, en primer orden, la desviación respecto de la idealidad. • Proporciona información acerca del potencial de interacción entre las moléculas (evidentemente si no existe este potencial sería cero). • Está relacionado con la interacción molécula-molécula (sin necesidad de incluir interacciones ternarias o de órdenes superiores). • A veces se puede calcular, teóricamente, su valor y comparar el potencial intermolecular con los datos experimentales. TEMPERATURA Y CURVA DE BOYLE • La temperatura de Boyle es la temperatura a la cual el segundo coeficiente del virial se hace nulo. Representa un punto en el que el gas se comporta de forma más ideal que en otras ocasiones. • La curva de Boyle es el lugar de los puntos del plano p,T en los que se cumple la condición: . Un gas ideal cumple esta condición en todo el plano p,T. • La temperatura de Boyle es el límite de la curva de Boyle a presión cero. pv∂ p∂ -------- T 0=
- 10. Física Térmica Física Térmica. GASES REALES 33 • Toda ecuación de estado de un gas real debe cumplir que el límite asintótico a presiones bajas tienda a la de un gas ideal. • Sin embargo, no es cierto que todas las propiedades de un gases real tiendan asintóticamente a las de un gas ideal. • La idea es que normalmente no es lo mismo hacer una operación matemática (derivar, por ejemplo) y computar sobre su resultado un límite, que computar primero el límite y sobre ese resultado efectuar la operación matemática. PROPIEDADES ASINTÓTICAS DE GASES REALES F f p 0→ lim F f( ) p 0→ lim≠ ejemplos diagrama de Amagat pv∂ p∂ -------- T B 2C'p 3D'p2 …+ + += pv∂ p∂ -------- Tp 0→ lim B= p p 0→ lim v∂ p∂ --------------------- T 0= gas ideal
- 11. Física Térmica Física Térmica. GASES REALES 34 coeficiente de compresibilidad κT 1 v --- p∂ ∂v T – κT id 1 pv ------ pv∂ p∂ -------- T –= = κT κT id – 1 pv ------ pv∂ p∂ -------- T – plog v∂ p∂ ----------------- T –= = κT κT id –( ) p 0→ lim B RT -------= coeficiente de dilatación α 1 v --- T∂ ∂v p 1 pv ------ pv∂ T∂ -------- p R dB dT -------p dC' dT --------p2 …+ + + RT Bp C'p2 …+ + + ------------------------------------------------------= = = α α id –( ) p 0→ lim 0= coeficiente de Joule µJ T∂ v∂ ------ u p cv ----- 1 Tα pκT ---------– = = µJ p 0→ lim 0=
- 12. Física Térmica Física Térmica. GASES REALES 35 µJK p 0→ lim T cp ----- Bd Td ------ B T ---– –= coeficiente Joule-Kelvin p1,T1 µJK p∂ ∂T h v cp ----- Tα 1–( )= = h=cte. p2,T2 µJK id 0= p1>p2
- 13. Física Térmica Física Térmica. GASES REALES 36 LEY DE LOS ESTADOS CORRESPONDIENTES a) observaciones experimentales • Antecedente: Todos los datos experimentales se representan de forma arbitraria como un número por una magnitud. La magnitud representa la unidad de medida (el metro, el segundo, el kelvin etc.) y en ella radica la arbitrariedad del dato experimental. Para una gas real estar a la temperatura de 300K o 10K no representa nada en sí mismo. Sólo es importante cuando se refiere a su temperatura crítica. Por ejemplo si esta fuera 200K en el primer caso estaríamos por encima de la temperatura y en el segundo por debajo. Pero si la temperatura crítica es 2K no hay ninguna diferencia entre 300K y 10K. • Normalmente se representan propiedades de los gases en ejes de coordendad de la presión o la temperatura expresadas en unidades SI. Estos diagrmas no permiten comparar datos de sustancias diferentes. • Cuando se representan las medidas experimentales tomadas sobre gases reales diferentes en unidades de las coordenadas críticas se observa un comportamiento universal. • Se definen: π p pc -----= φ v vc -----= θ T Tc -----=
- 14. Física Térmica Física Térmica. GASES REALES 37 ejemplo 1. segundo coeficiente del virial en coordenadas normales 2. segundo coeficiente del virial en coordenadas naturales
- 15. Física Térmica Física Térmica. GASES REALES 38 b) análisis teórico • Supongamos una ecuación térmica de estado que dependa paramétricamente de tres parámetros ajustables: . • El punto crítico de este sistema termodinámico será función de estos parámetros ajustables: • En condiciones físicas normales siempre es posible obtener una relación inversa y escribir: • Si se introducen estas relaciones en la ecuación térmica de estado se obtendrá está en la forma: • Si definimos ahora las coordenadas reducidas tendremos una ecuación de estado de la forma: • Es decir hemos obtenido una función universal: que representa el estado termodinámico de cualquier gas cuya ecuación de estado tenga la forma funcional de la que partimos. • Existe un teorema, llamado Pi de Buckingham, que asegura que siempre es posible el paso de a siempre con tal de que la función de partida sea dimensionalmente homogénea. Cosa distinta es que sea o no algebráicamente solucionable. f p v T a b c, , , , ,( ) 0= Tc Tc a b c, ,( )= pc pc a b c, ,( )= vc vc a b c, ,( )= a a Tc pc vc, ,( )= b b Tc pc vc, ,( )= c c Tc pc vc, ,( )= f p v T pc vc Tc, , , , ,( ) 0= π p pc -----= φ v vc -----= θ T Tc -----= f π φ θ 1 1 1, , , , ,( ) 0= f π φ θ, ,( ) 0= f p v T a b c, , , , ,( ) 0= f π φ θ, ,( ) 0=
- 16. Física Térmica Física Térmica. GASES REALES 39 EJEMPLO: LA ECUACIÓN DE VAN DER WAALS RTc 8 27 ------ a b ---= pc 1 27 ------ a b2 -----= vc 3b= se deduce entonces: b 1 3 ---vc= a 3pcvc 2 = R 8 3 --- pcvc Tc -----------= introduciendo estos valores en la ecuación del gas p 3pcvc 2 v 2 --------------+ v 1 3 ---vc– 8 3 --- pcvc Tc -----------T= π 3 φ2 ------+ φ 1 3 ---– 8 3 ---θ= es decir: ecuación reducida o universal del gas de van der Waals a=3, b=1/3, R=8/3 (en unidades críticas)
- 17. Física Térmica Física Térmica. GASES REALES 40 c) conclusión • Si los datos experimentales presentan un comportamiento universal y si una ecuación de tres parámetros implica también un comportamiento universal parece lógico buscar ecuaciones dependientes de tres parámetros como las que mejor representan la ecuación de estado térmico de un gas real. • Esto tiene una implicación directa: el potencial de interacción entre moléculas debe expresarse en función de pocos parámetros ajustables ya que los parámetros del potencial son los que determinan el valor de los parámetros de la ecuación de estado. • De los tres parámetros uno es, normalmente, la relación constante entre temperatura-energía o, si se prefiere, entre entropía-probabilidad: es la constante de Boltzamann kB, cuando se expresa el problema por partícula o la constante de los gases ideales R, cuando se expresa el problema por mol. • Los otros dos parámetros se relacionan con la interacción intermolecular que se suele escribir de la forma: donde ε y rm son los parámetros ajustables. • La hipótesis anterior funciona especialmente bien si la molécula es sencilla: particularmente si la molécula tiene simetría esférica (es decir no tiene bordes, brazos etc.). Es por esto que la ley de estados correspondientes se cumple muy en gases nobles y gases diatómicos inorgánicos pero pero en sustancias orgáncias o polares como el agua. V r( ) εf r rm ------ = O H H 104°
- 18. Física Térmica Física Térmica. GASES REALES 41 ¿CÓMO DETERMINAR PROPIEDADES DE UN GAS REAL? • La idea de buscar un expresión funcional que represente el comportamiento de un gases real es muy tentadora pero todavía no se ha encontrado una expresión mágica que encierre perfectamente todo el comportamiento de los gases. • Esta ecuación tiene demasiadas ligaduras. Entre ellas (por destacar algunas de las universales): la constante tiene que valer 0.3 aproximadamente. La temperatura de Boyle reducida tiene que ser 2.8 aproximadamente. La temperatura máxima de inversión reducida tiene que ser aproximadamente 5. • Existen varias alternativas que se basan más en la colección de datos experimentales que en expresiones funcionales. • Estas alternativas tratan de expresar o medir la diferencia entre el comportamiento real y ideal. Dos de ellas son las funciones de desviación que se estudiaron en el desarrollo del virial α y ∆. Son útiles para determinar los valores de los primeros coeficientes del virial pero están limitadas para valores moderados de la presión. zc pcvc RTc ----------=
- 19. Física Térmica Física Térmica. GASES REALES 42 • Otra técnica muy útil es estudiar el llamado factor de compresibilidad generalizado • Evidentemente el límite a bajas presiones de z es 1. La desviación respecto de la unidad marca la diferencia con el gas ideal. • Generalmente se hace uso de la ley de estados correspondientes y se representa el factor de compresibilidad generalizado en coordenadas reducidas. El diagrama provee de una ecuación de estado en el sentido de que determina las propiedades térmicas de los gases. • Evidentemente el diagrama es siempre aproximado puesto que la ley de estados correspondientes es solo aproximada. • En el diagrama de abajo se representa z=zcπφ/θ (con zc=0.27) como función de π. Las líneas se corresponden con θ=cte. Conocida π y θ se determina un punto del plano y de ahí la ordenada z. A partir de este valor se dermina, aproximadamente, φ. z pv RT -------=
- 20. Física Térmica Física Térmica. GASES REALES 43 • Otras posibilidades pasan por definir nuevas variables como por ejemplo el volumen pseudo-reducido: . • La primera ventaja es que no aparece vc que es una cantidad muy difícil de determinar experimentalmente. • La segunda ventaja es que los datos demuestran que la función representa mejor un comportamiento universal que la inicialmente calculada • Se puede construir un diagrama del factor de compresibilidad generalizado cuya tercera variable sea el pseudo-volumen dotándolo de mayor universalidad. • Otra posibilidad es definir una función del tipo donde ω es el llamado factor acéntrico y representa la falta de esfericidad de la molécula. φ˜ v RTc pc⁄ ------------------= f π θ φ˜, ,( ) 0= f π θ φ, ,( ) 0= f π θ φ ω, , ,( ) 0= • Lo estudiado en este tema es sólo una parte del problema de describir las propieades térmicas de un gas real. • Nos hemos centrado en las variables de la ecuación térmica de estado y en las relaciones entre ellas. • La ecuación térmica de estado NO es una ecuación fundamental y NO contiene toda la información termodinámica del sistema. • Es necesario el estudio de los calores específicos de los gases para completar el estudio termodinámico.
