Fuerzas intermoleculares mapa (2)
•Descargar como DOCX, PDF•
1 recomendación•13,524 vistas
Fuerzas intermoleculares mapa (2)
Denunciar
Compartir
Denunciar
Compartir
Recomendados
Más contenido relacionado
La actualidad más candente
La actualidad más candente (20)
Informe de Práctica de Laboratorio de Enlaces Químicos

Informe de Práctica de Laboratorio de Enlaces Químicos
Quimica organica nomenclatura respuesta ejercicios

Quimica organica nomenclatura respuesta ejercicios
Similar a Fuerzas intermoleculares mapa (2)
Similar a Fuerzas intermoleculares mapa (2) (20)
PRESENTACIÓN DE FUERZAS INTERMOLECULARES 2021A.pptx

PRESENTACIÓN DE FUERZAS INTERMOLECULARES 2021A.pptx
Más de Yesenia Jimenez
Más de Yesenia Jimenez (20)
Último
Centros Multigrados Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...Katherine Concepcion Gonzalez
Diapositivas de mi seminario "Usos y desusos de la inteligencia artificial en revistas científicas", facilitado a editores de revistas científicas de Iberoamérica en el XIII Congreso Internacional sobre Revistas Científicas (CRECS 2024), el 8 de mayo de 2024 en la ciudad de Arequipa, Perú, en el campus de la Universidad Católica de Santa María.Usos y desusos de la inteligencia artificial en revistas científicas

Usos y desusos de la inteligencia artificial en revistas científicasJuan D. Machin-Mastromatteo #Juantífico
Último (20)
Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...
Usos y desusos de la inteligencia artificial en revistas científicas

Usos y desusos de la inteligencia artificial en revistas científicas
Prueba de evaluación Geografía e Historia Comunidad de Madrid 2º de la ESO

Prueba de evaluación Geografía e Historia Comunidad de Madrid 2º de la ESO
RESOLUCIÓN VICEMINISTERIAL 00048 - 2024 EVALUACION

RESOLUCIÓN VICEMINISTERIAL 00048 - 2024 EVALUACION
La Sostenibilidad Corporativa. Administración Ambiental

La Sostenibilidad Corporativa. Administración Ambiental
PP_Comunicacion en Salud: Objetivación de signos y síntomas

PP_Comunicacion en Salud: Objetivación de signos y síntomas
Prueba libre de Geografía para obtención título Bachillerato - 2024

Prueba libre de Geografía para obtención título Bachillerato - 2024
🦄💫4° SEM32 WORD PLANEACIÓN PROYECTOS DARUKEL 23-24.docx

🦄💫4° SEM32 WORD PLANEACIÓN PROYECTOS DARUKEL 23-24.docx
Fuerzas intermoleculares mapa (2)
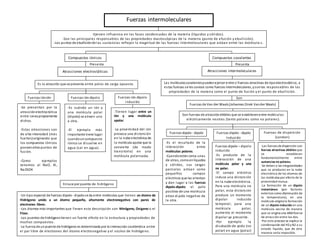
- 1. Son Presenta n Fuerzas intermoleculares Presenta n -Ejercen influencia en las fases condensadas de la materia (líquidos y sólidos). -Son las principales responsables de las propiedades macroscópicas de la materia (punto de efusión y ebullición). -Los puntos de ebulliciónde las sustancias reflejan la magnitud de las fuerzas intermoleculares que actúan entre las molécula s. Compuestos iónicos Compuestos covalentes Atracciones electrostáticas Atracciones intermoleculares Es la atracción que se presenta entre polos de carga opuesta. Las moléculascovalentespuedenejercer entre sí fuerzas atractivas de tipoelectrostático, a estas fuerzas se les conoce como fuerzas intermoleculares, ysonlas responsables de las propiedades de la materia como el punto de fusión y el punto de ebullición. -Se presentan por la atracciónelectrostática entre ionespropiamente dichos. -Estas atracciones son de alta intensidad (más fuertes)originando que los compuestos iónicos poseanaltos puntos de fusión. -Como ejemplos tenemos al NaCl, KI, Na2SO4 -Es cuándo un ión y una molécula polar (dipolo) se atraen uno a otra. -El ejemplo más importante tiene lugar cuandouncompuesto iónico se disuelve en agua (sal en agua). -Tienen lugar entre un ión y una molécula apolar. -La proximidad del ión provoca una distorsión en la nube electrónica de la molécula apolar que la convierte (de modo transitorio) en una molécula polarizada. Fuerzas ión-ión Fuerzas ión-dipolo Fuerzas ión-dipolo inducido Son fuerzas de atraccióndébiles que se establecenentre moléculas eléctricamente neutras (tanto polares como no polares). Fuerzas de Van der Waals(Johannes Direk Vander Waals) -Las fuerzas dedispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustanciasno polares. -Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. -La formación de un dipolo instantáneo (por factores externos como disminución de la temperatura), en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débilfuerza de atracción entre las dos. -Por este proceso se explica la condensación del H2y N2 a su estado líquido, que de otra manera sería imposible. Fuerzas dipolo – dipolo inducido -Es producto de la interacción de una molécula polar y una no polar. -El campo eléctrico induce una distorsión en la nube electrónica. Para una molécula no polar, esta distorsión produce un momento dipolar inducido temporal; para una molécula polar, aumenta el momento dipolar ya presente. -Por ejemplo la disolución de yodo (no polar) en agua (polar) -Un tipo especial de fuerzas dipolo - dipolose da entre moléculas que tienen un átomo de Hidrógeno unido a un átomo pequeño, altamente electronegativo con pares de electrones libres. -Los átomos más importantes que llevan esta descripción son Nitrógeno, Oxígeno o el Flúor. -Los puentes de hidrógenotienen un fuerte efecto en la estructura y propiedades de muchos compuestos. -La fuerza de unpuente de hidrógeno es determinada por la interacción coulómbica entre el par libre de electrones del átomo electronegativo y el núcleo de hidrógeno. -Es el resultado de la interacción entre moléculas polares. -Cuandoestán cerca unas de otras, comoenlíquidos y sólidos, sus cargas parciales actúan como pequeños campos eléctricos que las orientan y dan lugar a las fuerzas dipolo-dipolo: el polo positivo de una molécula atrae el polo negativo de la otra. Fuerzas dipolo - dipolo Fuerzas dipolo - dipolo Inducido Fuerzas de dispersión (London) Enlace por puente de hidrógeno