Expression d'une protéine recombinante
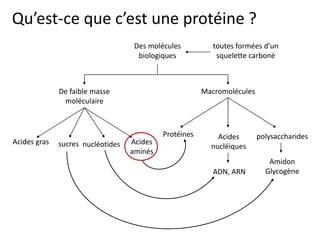
- 1. Qu’est-ce que c’est une protéine ? Des molécules toutes formées d'un biologiques squelette carboné De faible masse Macromolécules moléculaire Protéines Acides polysaccharides Acides gras sucres nucléotides Acides nucléiques aminés Amidon ADN, ARN Glycogène
- 4. Primaire Acides aminés Feuillet bêta Hélice alpha Secondaire Tertiaire Quaternaire
- 5. Fonctions des protéines Structurale Le collagène. C’est une protéine qui forme des fibres. Celles-ci se trouvent dans tous les animaux. Elles sont secrétées par les cellules le tissu conjonctif comme les fibroblastes, ainsi que par d’autres types des cellules. Le collagène est le composant le plus abondante de la peau les tendons et les os. Le collagène représente le 25% de la masse totale de protéines chez les mammifères.
- 6. Fonctions des protéines Immunitaire Les anticorps Paratope Groupe Groupe Groupe Groupe A B AB O Globules rouges Anticorps Anti-B Anti-A Aucun Anti-A Anti-B Antigènes A B A et B Aucun
- 7. Fonctions des protéines Catalytique Les enzymes. Ces protéines ont la propriété de catalyser ou accélérer les réactions chimiques qui ont lieu dans les cellules et dans les milieux extracellulaires. Si les enzymes n’étaient pas présents, les réactions chimiques se feraient à une vitesse si faible que la vie ne serait pas possible.
- 9. Le code génétique universel
- 10. Production de protéines thérapeutiques La déficit de production de certaines protéines ou la production de certaines protéines non fonctionnelles dans l’organisme amène fréquemment à des maladies qui peuvent être Cependant, de nombreuses protéines graves. humaines ayant une valeur pharmaceutique importante sont Ces maladies peuvent parfois être traitées par obtenues difficilement à partir de leur l'administration clinique de la protéine source naturelle. provenant de sources externes. La technologie de protéines recombinantes, apparue à la fin des années 70, offre une plateforme technique très puissante pour la production contrôlée de protéines d'intérêt par des procédures relativement bon marché.
- 11. Recombinaison génétique Les protéines recombinantes sont des protéines produites par des cellules dont l'ADN a été modifié par recombinaison génétique. La recombinaison génétique est un échange d‘information génétique entre deux génomes différents. Un gène codant une protéine d'intérêt est introduit dans le génome de l'espèce productrice. Les protéines recombinantes peuvent être purifiées et utilisées à des fins thérapeutiques, industrielles ou bien encore dans les activités de recherche.
- 12. Production de protéines recombinantes
- 13. Construction d’une molécule recombinante Plasmide d’expression Gène de PqsD Plasmide recombinant Gène de PqsD provenant de Pseudomonas aeruginosa
- 14. Notre plasmide d’expression PqsD 6His pET28 Ori Kan
- 15. Transformation de notre souche d’expression E. Coli BL21
- 16. Étapes pour la production de notre protéine recombinante Milieu Pré-culture Culture Centrifuger Culot : Cellules Inoculer notre Inoculer 100 ml de milieu LB Collecter les cellules par Garder le culot cellulaire à bactérie (souche avec notre pré-culture de centrifugation à 7000 -20°C jusqu'au jour de la d’expression) dans 5 façon à obtenir une D0600 rpm/15min/4°C lyse. ml de milieu LB ou TSB initiale de 0,05. + kan 30 µg/ml Laver le culot cellulaire avec Incuber à 37°C/240rpm 70ml de tampon de lavage. Incuber à 37°C/over night/sous agitation Lors qu’une DO600 de 0,6 est Recollecter les cellules par atteinte, induire avec 1 mM centrifugation à 7000 d’IPTG final rpm/15min/4°C Incuber 2h de plus
- 17. Étapes pour la purification de notre protéine recombinante Culot : Cellules Lyse cellulaire Séparation de fractions cellulaires Lyse: Resuspendre le culot cellulaire Séparation des fractions cellulaires: Fraction congelé à 20°C dans 6ml de tampon Centrifuger à 20000xg/30min/4°C Cytoplasmique Fraction (surnageant) de lyse Bugbuster®. pour décanter la fraction Membranaire membranaire. (culot) Vortexer pour détacher le culot des parois du tube en plastique. Diluer le surnageant obtenu avec 6 ml de tampon d’imidazole 10mM. Incuber sous agitation douce à Étant donné que notre protéine température pièce pendant 20 Filtrer avec un filtre de 0,2µm pour recombinante se trouve soluble minutes. éliminer les débris cellulaires en dans le cytoplasme, on purifiera suspension. donc notre protéine à partir de cette fraction.
- 18. Chromatographie d’absorption ou d’affinité Les chromatographies d'adsorption est un méthode de séparation où la molécule d'intérêt d'un mélange complexe est isolée des autres constituants parce qu'elle se lie spécifiquement à la résine ou matrice sur laquelle on fait la chromatographie. Mélange Peu Beaucoup complexe d’affinité d’affinité Élimination de protéines non- Élution de la spécifiques protéine du mélange d’intérêt pure FPLC Fast protein liquid chromatography
- 19. Étapes de la chromatographie d’affinité 1. Lavage de la colonne de nickel. Laver la colonne en passant 25ml de l’eau distillée à débit de 5ml/miné. Cette étape permet d’éliminer l’éthanol qui est présente dans la colonne. 2. Équilibration de la colonne: Équilibrer la colonne en passant 25ml d’une solution d’imidazole 10mM à débit de 5ml/min. 3. Injecter l’échantillon contenant notre protéine à débit de 1ml/min.
- 20. 5. Lavage de la colonne: Laver la colonne avec une solution d’imidazole 10mM pour éliminer les protéines non spécifiques liées à la colonne. Débit 2ml/min pendant 7,5 minutes. 6. Élution: Éluer notre protéine recombinante en faisant un gradient linéaire d’imidazole de 10mM à 250mM. Débit 2ml/min pendant 50 minutes. Imidazole
- 21. Imidazole 250mM Étape d’élution. Concentration croissante d’imidazole (Gradient) Étape d’injection et lavage. Concentration constante d’imidazole (10mM) Collecte le volume Fractions d’élution collectées de 2ml mort
- 22. Électrophorèse de protéines en conditions dénaturantes ou SDS-PAGE L'électrophorèse a pour but de séparer des molécules chargées au travers d'un gel (un polymère) sous l'effet d'un champ électrique. On fait bouillir un mélange de protéines en Ces charges se repoussent et déplient les présence : chaînes polypeptidiques. •d'un agent réducteur : le β-mercaptoéthanol En conséquence : qui réduit les ponts disulfure. •les protéines sont dénaturées : elles ont perdu leur structure tridimensionnelle native •d'un détergent anionique fort : le SDS qui enveloppe les chaînes polypeptidiques des •les protéines n'ont plus de ponts disulfure : protéines de charges négatives. elles sont sous une forme monomérique
- 24. Électrophorèse SDS-PAGE Fractions à analyser: Volume mort, fraction 10, 15, 20, 25, 30, 35, 40, 45, 50, contrôle positif. Préparation des échantillons: Volume de fraction: 80µl Volume de loading buffer (5x) 20µl Volume final: 100µl Chauffer l’échantillon préparé à 95°C/5min. Déposer entre 60 à 80µl dans les puits. Direction de l’électrophorèse Migrer à 70 volts/over night Lorsque le gel aura migré complètement, colorer à l’argent Vérifier le présence d’une bande correspondant à notre protéine d’intérêt.