7 paskaita.2012
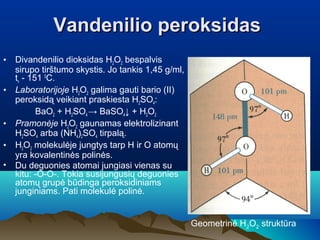
- 1. Vandenilio peroksidas • Divandenilio dioksidas H2O2 bespalvis sirupo tirštumo skystis. Jo tankis 1,45 g/ml, tv - 151 0C. • Laboratorijoje H2O2 galima gauti bario (II) peroksidą veikiant praskiesta H2SO4: BaO2 + H2SO4 → BaSO4↓ + H2O2 • Pramonėje H2O2 gaunamas elektrolizinant H2SO4 arba (NH4)2SO4 tirpalą. • H2O2 molekulėje jungtys tarp H ir O atomų yra kovalentinės polinės. • Du deguonies atomai jungiasi vienas su kitu: -O-O-. Tokia susijungusių deguonies atomų grupė būdinga peroksidiniams junginiams. Pati molekulė polinė. Geometrinė H2O2 struktūra
- 2. Vandenilio peroksidas • H2O2 yra silpna rūgštis. Jis gali sudaryti dviejų rūšių druskas: neutraliąsias – peroksidus ir rūgščiąsias – vandenilio peroksidus. H2O2 ↔ H+ + HO2- NaHO2 – natrio vandenilio peroksidas HO2- ↔ H+ + O22- Na2O2 – natrio peroksidas • Dėl O-1 atomo molekulėje vandenilio peroksidas gali būti ir oksidatorius, ir reduktorius. • O-1 OL gali didėti iki 0 (redukcinės savybės) ir mažėti iki – 2 (oksidacinės savybės). • Stipresnės oksidacinės savybės. • Rūgščioje terpėje gali reaguoti. H2O2 + 2H+ +2e → 2H2O (O) H2O2 - 2e → O2 + 2H+ (R) • Šarminėje ir neutralioje terpėje. H2O2 +2e → 2HO- (O) H2O2 + 2HO- - 2e → O2 + 2H2O (R)
- 3. Vandenilio peroksidas • Odos ir gleivinių paviršiuje yra fermentų katalazių, kurios skatina H2O2 skilimą. • Reakcijos metu išsiskiriantis deguonis veikia baktericidiškai, t.y. naikina bakterijas. Dėl šios savybės 3 % koncentracijos H 2O2 tirpalas vartojamas medicinoje ir farmacijoje žaizdoms dezinfekuoti, gerklei skalauti. Fe2+ + H2O2 → Fe3+ + HO· + HO- HO· + H2O2 → H2O + HO2· Fe3+ + HO2· → Fe2+ + O2 + H+ Fe2+ 2H2O2 → 2H2O + O2 • Ilgai stovėdami, ypač blogai uždarytuose induose, šviesoje, esant šarmo pėdsakams, H2O2 tirpalai skyla savaime, disproporcionuoja. 2H2O2 → O2 + 2H2O
- 4. Berilis. Amfoteriškumas • Tai pilkas, panašus į plieną metalas, kietas ir trapus. • Be savybės panašesnės į Al, o ne į Mg savybes. • Metalas amfoterinis, amfoterinis jo oksidas ir hidroksidas. Be + 2HCl → BeCl2 + H2 Be + 2KOH + 2H2O → K2[Be(OH)4] + H2 BeO + 2HCl → BeCl2 + H2O BeO + 2KOH + H2O → K2[Be(OH)4] Be(OH)2 + 2HCl → BeCl2 + 2H2O Be(OH)2 + 2KOH → K2[Be(OH)4] Berilio junginiai yra nuodingi.
- 5. Aliuminis. Amfoteriškumas • Aliuminis chemiškai aktyvus, amfoterinis, tirpsta rūgštyse ir šarmuose. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2 Al + NaOH + 5H2O → Na[Al(OH)4(OH2)2] + 3/2H2 • Aliuminis stiprus reduktorius, atsparus korozijai, nes jo paviršių greitai padengia oksido plėvelė. • Šaltoje koncentruotoje HNO3 rūgštyje pasyvuojasi ir ja paveiktas su rūgštimis nebereaguoja.
- 6. Al2O3 - korundas Al2O3 ir Cr Rubinas Al2O3 ir Ti, Fe Safyras
- 7. Aliuminio junginiai • Aliuminio hidroksidas Al(OH)3 – balti milteliai, amfoterinis, vandenyje netirpsta. Al(OH)3 ↔ H3AlO3 • Al druskos - bespalvės, kristalai, gerai tirpsta vandenyje dėl stiprių Al3+ poliarizacinių savybių. • Druskų tirpalai rūgštūs. Greitai drumsčiasi išsiskiriant Al(OH)3 nuosėdoms. Al3+ + 3HOH → Al(OH)3↓ + 3H+
- 8. Aliuminio perdirbimas Energijos sąnaudos – 1 mol Al iš boksito 297kJ, (temperatūra 1000 0C), perdirbant (660 0C) - 26,1 kJ.
- 9. Korozija • Ore visada yra H2O garų ir CO2. H2O + CO2 ↔ HCO3- + H+ • H+ yra elektronų akceptoriai, kurių donoras HCO3- ir Fe. Fe – 2e → Fe2+ • Elektronus prisijungia H+ ir oro O2, kuris yra oksidatorius. 2H+ + 2e → H2 O2 + 4H+ + 4e → 2H2O • Vanduo mažai disocijuoja. H2O ↔ H+ + HO- • Fe2+ reaguoja su HO-. Fe2+ + 2HO- → Fe(OH)2 • Geležies (II) hidroksidą oksiduoja deguonis. 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 • Suminė geležies korozijos lygtis. 4Fe + 3O2 + 6H2O → 4Fe(OH)3
- 10. Korozija. Antikorozinės dangos • Kad nekoroduotų, geležis dažoma, lakuojama, dengiama polimerais, korozijai atspariais metalais, pvz., Sn arba Zn. • Padengus Sn, susidaro galvaninis elementas. Danga patvari tol, kol Sn sluoksnyje nėra įbrėžimų. Subraižytas Sn tampa katodu, nes yra mažiau aktyvus už Fe. Geležies elektronai keliauja į alavą. Fe – 2e → Fe2+ Sn2+ + 2e → Sn Fe + Sn2+ → Fe2+ + Sn • Geležis koroduoja greičiau už nepadengtą.
- 11. Korozija. Antikorozinės dangos • Zn už Fe aktyvesnis, vykstanti sąveika aprašoma lygtimi: Fe2+ + Zn → Fe + Zn2+ • Fe pradeda koroduoti tik tada, kai suyra visa cinko danga. • Alavu padengta geležis vadinama alavuota skarda, padengta cinku – cinkuota skarda. Alavo danga yra katodinė, cinko – anodinė, nes elektrocheminiuose procesuose geležies atžvilgiu alavas esti katodas, cinkas – anodas. • Žinomi ir kitokie geležies apsaugos nuo korozijos būdai.
- 12. Korozija Vanduo Vanduo Geležis Geležis