Aula 08 isomeria e estereoquimica
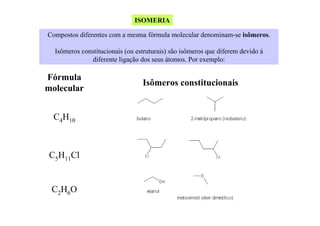
- 1. ISOMERIA Compostos diferentes com a mesma fórmula molecular denominam-se isômeros. Isômeros constitucionais (ou estruturais) são isômeros que diferem devido à diferente ligação dos seus átomos. Por exemplo: Fórmula molecular C4H10 C5H11Cl C2H6O Isômeros constitucionais
- 2. ISOMERIA Os isômeros constitucionais podem ser subdivididos em: a) Isomeria de Função; b) Isomeria de Cadeia; c) Isomeria de posição; d) Isomeria de Compensação ou Metameria; e) Isomeria Dinâmica ou Tautomeria. -Nem todos os grupos estão unidos ao mesmo centro -São moléculas muito diferentes tanto em suas propriedades físicas como químicas.
- 3. ISOMERIA a) Isomeria de Função A diferença entre os isômeros está no grupo funcional.
- 4. ISOMERIA b) Isomeria de Cadeia A diferença entre os isômeros está no tipo de cadeia carbônica.
- 5. ISOMERIA c) Isomeria de Posição A diferença entre os isômeros está na posição de um grupo funcional, de uma insaturação ou de um substituinte.
- 6. ISOMERIA d) Isomeria de Compensação ou Metameria A diferença entre os isômeros está apenas na posição de um heteroátomo.
- 7. ISOMERIA e) Tautomeria Este tipo de isomeria ocorre quando dois compostos de mesma fórmula molecular e grupos funcionais diferentes coexistem em equilíbrio dinâmico no qual um deles está continuamente se transformando no outro e vice-versa. A tautomeria ocorre somente na fase líquida, em compostos cuja molécula possui um elemento muito eletronegativo, como o oxigênio ou nitrogênio, ligado ao mesmo tempo ao hidrogênio e a um carbono insaturado (que possui ligação π).
- 8. ESTEREOQUÍMICA QUÍMICA NOVA, 20(6) (1997) OS FÁRMACOS E A QUIRALIDADE: UMA BREVE ABORDAGEM
- 10. ESTEREOQUÍMICA E COM OS ALIMENTOS ? DOCE AMARGO
- 11. ESTEREOQUÍMICA MOLÉCULA AQUIRAL É aquela que é superponível com sua imagem no espelho Têm elementos de simetria
- 12. ESTEREOQUÍMICA MOLÉCULA QUIRAL É aquela que não é superponível com sua imagem no espelho
- 13. ESTEREOQUÍMICA Estuda as estruturas moleculares em três dimensões; Estereoisômeros Enantiômeros (enantion, grego oposto) Diastereoisômeros São produtos diferentes?
- 14. ESTEREOQUÍMICA ISÔMEROS ESTEREOISÔMEROS CONSTITUCIONAL ENANTIÔMEROS Imagem da molécula em um espelho plano não é sobreponível a ela mesmo Todo enantiômero deve possuir um centro quiral Espelho DIASTEREOISÔMEROS Imagem da molécula, em um espelho plano é sobreponível a ela mesmo
- 15. ESTEREOQUÍMICA CENTRO QUIRAL Carbono com quatro grupos diferentes ligados a ele Carbono QUIRAL Também chamado de centro quiral; Características deste carbono: Assimétrico; Geometria tetraédrica; Hibridação sp3;
- 16. ESTEREOQUÍMICA COMO IDENTIFICAR UMA MOLÉCULA QUIRAL 1. 2. Ao avaliar a sobreposição não devemos “romper ou formar” ligações; Para ser uma molécula quiral basta uma única região do molécula não coincidir com a outra imagem; Espelho III e IV Não são superponíveis ENANTIÔMEROS
- 17. ESTEREOQUÍMICA COMO IDENTIFICAR UMA MOLÉCULA QUIRAL 3. Moléculas quirais não possuem plano de simetria; Plano de simetria Esta molécula é AQUIRAL Possui plano de simetria Esta molécula também possui plano de simetria AQUIRAL
- 18. ESTEREOQUÍMICA COMO IDENTIFICAR UMA MOLÉCULA QUIRAL 2-cloropropano 2-clorobutano
- 19. ESTEREOQUÍMICA CENTRO QUIRAL Outros átomos que também podem fazem quatro ligações pode ser um centro quiral; 1. Devido a geometria tetraédrica o centro quiral do carbono pode existir em ambos os arranjos tridimensionais que não são imagens superponíveis; Estereoisômeros as imagens não são superponíveis 2-butanol
- 20. ESTEREOQUÍMICA Propriedades de moléculas quirais • Os ENANTIÔMEROS possuem as mesmas propriedades FÍSICAS (P.F; P.E; Espectro IV; UV; RMN se medidos em solventes aquirais) EXCETO O SENTIDO DE ROTAÇÃO DO PLANO DE POLARIZAÇÃO DA LUZ. • Os ENANTIÔMEROS possuem as mesmas propriedades QUÍMICAS EXCETO AS REAÇÕES COM OUTROS COMPOSTOS OPTICAMENTE ATIVOS. ATIVIDADE ÓTICA DE MOLÉCULAS QUIRAIS DEXTROROTATÓRIAS (d, +) LEVOROTATÓRIAS (l,-) Gira a luz polarizada para a direita Gira a luz polarizada para a esquerda
- 21. ESTEREOQUÍMICA COMPOSTO OPTICAMENTE ATIVO São capazes de modificar a rotação da luz polarizada; COMPOSTOS QUIRAIS SÃO OPTICAMENTE ATIVOS MISTURA RACÊMICA Mistura de partes iguais dos enantiômeros (+) e (-). IMPORTÂNCIA DA QUIRALIDADE 1. A quiralidade está difundida em todo o universo; 2. O corpo humano é estruturalmente QUIRAL; 3. A maioria das moléculas dos seres vivos são quirais e, geralmente, somente um tipo é encontrado; 4. Quase todos os aminoácidos que formam as proteínas são quirais e todos desviam a luz para a esquerda (levorotatórios);
- 22. ESTEREOQUÍMICA
- 23. ESTEREOQUÍMICA ATIVIDADE ÓTICA Descoberto pelo físico João-Baptista Biot – 1815; 1848 Luis Pasteur princípio da estereoquímica Os enantiômeros giram o plano da luz polarizada em iguais quantidades mas em direções opostas; Onda eletromagnética Ou seja, enantiômeros resolvidos (separados) apresentam atividade ótica; As oscilações do campo elétrico e magnético podem ocorrer em todos os possíveis planos perpendiculares a direção de propagação.
- 24. ESTEREOQUÍMICA ATIVIDADE ÓTICA Onda eletromagnética polarizada Quando um feixe de luz comum passa através de um polarizador; O polarizador interage com o campo elétrico da luz; Após a interação a luz emerge do polarizador oscilando apenas em um plano; POLARÍMETRO Equipamento capaz de polarizar a luz; A lente geralmente é constituída de CaCO3 em determinada forma cristalina Chamado de polaróide PRISMA DE NICOL;
- 26. ESTEREOQUÍMICA ATIVIDADE ÓTICA POLARÍMETRO A) Polarímetro sem amostra; B) Observação de uma amostra que não é opticamente ativa; C) Observação de uma amostra que é opticamente ativa; Rotação da luz polarizada;
- 27. ESTEREOQUÍMICA ATIVIDADE ÓTICA MEDIÇÃO Medições realizadas em graus; A rotação pode ocorrer para duas direções: DIREITA (SENTIDO DO RELÓGIO) dextrorotatório (d, +) Assume-se valor POSITIVO ESQUERDA (SENTIDO CONTRÁRIO DO RELÓGIO) NEGATIVO Levorotatória (l, -); FATORES QUE INFLUENCIAM: Concentração da solução; Comprimento de onda utilizado na fonte de luz; Comprimento do tubo de amostra; Temperatura; Natureza do solvente. Assume-se valor
- 28. ESTEREOQUÍMICA ATIVIDADE ÓTICA ROTAÇÃO ESPECÍFICA D = raia D do sódio (589,6 nm); T = temperatura, 0C; α= rotação observada, graus L = comprimento do tubo de amostra, cm C = concentração da solução, g.mL-1 OBS: NO SI am = Poder rotatório ótico específico (rad m2 kg-1)
- 30. ESTEREOQUÍMICA NOMENCLATURA ENANTIÔMEROS: SISTEMA (R-S) 1. Não existe correlação entre a configuração do enantiômero e a direção da rotação ótica; 2. Não existe correlação entre a designação R e S e a direção de rotação ótica; R Do latin rectus (direito – a favor do relógio) S Do latin sinister (esquerdo – contra o relógio) COMO DETERMINAR A PRIORIDADE DOS GRUPOS?
- 31. ESTEREOQUÍMICA NOMENCLATURA ENANTIÔMEROS: SISTEMA (R-S) BASES (regras de precedência): 1. Número atômico do elemento ligado ao centro quiral • Menor número atômico menor prioridade (4) • Maior número atômico maior prioridade (1) OBS: No caso de isótopos o de maior massa atômica tem maior prioridade 2. Quando os átomos ligados ao centro quiral forem iguais passa-se a determinar a prioridade pelo próximo átomo; 3. Deve-se posicionar o grupo de menor precedência (4) na posição contrária ao observador (atrás do plano); Visão da molécula com o grupo de menor prioridade apontando para fora do plano
- 33. ESTEREOQUÍMICA BASES: 3. Quando houver ligações duplas ou triplas deve-se duplicar ou triplicar ambos os átomos; (S)-Alanina [(S)-(+)-2-ácido aminopropionico] [α]D = +8.5° (S)-Gliceraldeído [(S)-(–)-2,3-dihidroxipropanal], [α]D = –8.7°
- 35. ESTEREOQUÍMICA NOMENCLATURA ENANTIÔMEROS: SISTEMA (R-S) PROJEÇÕES DE FISCHER 1. As linhas verticais representam ligações que se projetam para trás do plano do papel (ou que estão no plano do papel); 2. As linhas horizontais representam ligações que se projetam para fora do plano do papel; 3. As intersecções das linhas horizontais e verticais representa um átomo de carbono, normalmente um carbono quiral; 4. Quando usamos as projeções de Fischer para testar a superponibilidade de duas estruturas é permitido girá-las de 1800 no plano do papel; 5. Não podemos girar as estruturas de nenhum outro ângulo; 6. Deve-se manter as estruturas no plano do papel; 7. Não é permitido virar as estruturas Fischer
- 36. ESTEREOQUÍMICA MISTURA RACÊMICA Mistura de partes iguais de enantiômeros; São opticamente inativos; Podem ser separados: Solventes quirais; Cromatografia com coluna quiral; Reações que envolvam substâncias também quirais; Butanona Aquiral hidrogênio Aquiral (±)-2-butanol quiral
- 37. ESTEREOQUÍMICA DIASTEREOISÔMEROS São estereoisômeros cujas moléculas não são imagens especulares superponíveis; São moléculas que apresentam dois ou mais centros quirais (exceto para isômeros cis, trans onde as moléculas não apresentam centros quirais); Para compostos cujos centros quirais são tetraédricos (sp3) o número total de estereoisômeros não excederá 2n, onde n é o número de centros quirais tetraédricos (regra de van’t Hoff); Os diasteroisômeros apresentam propriedades físicas diferentes (P.F; P.E; solubilidades, etc.);
- 38. ESTEREOQUÍMICA DIASTEREOISÔMEROS Exemplos de diasteroisômeros sem carbono quiral DIASTEROISÔMEROS
- 39. ESTEREOQUÍMICA DIASTEREOISÔMEROS Exemplos de diasteroisômeros com dois carbonos quirais DIFERENTES PROPRIEDADES FÍSICAS DISTEROISÔMEROS ENANTIÔMEROS ENANTIÔMEROS MESMAS PROPRIEDADES FÍSICAS E QUÍMICAS
- 40. ESTEREOQUÍMICA DIASTEREOISÔMEROS Exemplos de diasteroisômeros com DOIS carbonos quirais Diasteroisômeros Exemplos de diasteroisômeros com UM carbono quiral
- 42. ESTEREOQUÍMICA DIASTEREOISÔMEROS MESOESTRUTURAS Estruturas com dois carbonos quirais nem sempre possuem 4 estereoisômeros; Ocorre com moléculas que mesmo contendo centros quirais elas são aquirais.
- 44. CLASSIFICAÇÃO DAS RELAÇÕES ENTRE MOLÉCULAS São superponíveis? SIM Tem a mesma fórmula molecular? OU São iguais em seus pesos moleculares e suas composições elementares? NÃO Não são isômeros NÃO SIM São a mesma molécula Diferem unicamente pelo NÃO arranjo de seus átomos no espaço? São isômeros São isômeros estruturais SIM É um deles superponível com a imagem no espelho do outro? SIM São enântiômeros São quirais NÃO NÃO São diasteroisômeros NÃO São intercambiáveis a temperatura ambiente? São estereoisômeros São estereoisômeros conformacionais São superponíveis com suas respectivas imagens no espelho? SIM SIM São estereoisômeros figuracionais São aquirais
