Nomemclatura química 2011
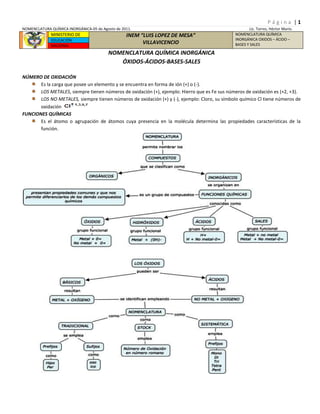
- 1. MINISTERIO DEINEM “LUIS LOPEZ DE MESA”VILLAVICENCIONOMENCLATURA QUÍMICA INORGÁNICA OXIDOS – ÁCIDO – BASES Y SALESEDUCACIÓNNACIONAL<br />NOMENCLATURA QUÍMICA INORGÁNICA<br />ÓXIDOS-ÁCIDOS-BASES-SALES<br />NÚMERO DE OXIDACIÓN<br />Es la carga que posee un elemento y se encuentra en forma de ión (+) o (-).<br />LOS METALES, siempre tienen números de oxidación (+), ejemplo: Hierro que es Fe sus números de oxidación es (+2, +3).<br />LOS NO METALES, siempre tienen números de oxidación (+) y (-), ejemplo: Cloro, su símbolo químico Cl tiene números de oxidación <br />FUNCIONES QUÍMICAS<br />Es el átomo o agrupación de átomos cuya presencia en la molécula determina las propiedades características de la función.<br />LOS COMPUESTOS SE NOMBRAN DE ACUERDO A LOS NÚMEROS DE OXIDACIÓN y PREFIJOS NUMÉRICOS<br />LOS ELEMENTOS QUE CONTENGANTIENEN LOS PREFIJOS Y SUFIJOSSISTEMA-TRADICIONALNÚMERO OXIDACIÓNÁCIDOSAL1# de Oxidación………….ico………..ato2# de OxidaciónMenor número………oso…………itoMayor número………ico………..ato3 # de OxidaciónMenor númeroHipo…osoHipo….itoSiguiente número…………oso………...itoMayor número…………ico………….ato4 # de OxidaciónMenor númeroHipo…..osoHipo……itoSiguiente número…………oso…………..itoMás estable de los números………..ico……….…atoMayor númeroPer…….icoPer………ato<br />PREFIJOS NUMÉRICOS1Mon…………..2Di….. = Bi……3Tri……………..4Tetr……………5Pent……………6Hex……………..7Hept……………8Octa…………….9Non……………..10Deca……………..11Undeca………….<br />OXIDOS BÁSICOS<br />Estos óxidos, se obtienen mediante enlaces iónicos.<br />La reacción general es: M + 02 -> M20n. Donde M representa el metal y (n) el estado de oxidación del elemento con el cual el átomo puede formar compuestos<br />Los números de oxidación de los elementos, se intercambian; es decir se cruzan entre ellos y se colocan como subíndices (si el # de oxidación es par, puede simplificarse, exceptuando en los peróxidos)<br />Estos compuestos abundan en la naturaleza y tienen varias aplicaciones, como el óxido de zinc para la fabricación de pinturas y el óxido de calcio conocido como cal viva, utilizado en la construcción.<br />EJEMPLOS.<br />4K + 02 -> 2K20 <br />4Fe + 302 -> 2Fe203<br />FORMULANÚMEROS DEOXIDACIÓNNOMBRE TRADICIONALNOMBRE STOCKNOMBRE SISTEMÁTICOK20+1Óxido de potasioÓxido potásicoÓxido de potasio (I)Monóxido de dipotasioFe0+2Óxido ferrosoÓxido de hierro (II)Monóxido de hierroFe203+3Óxido férricoÓxido de hierro (III) Trióxido de dihierroCr0+2Óxido HipocromosoÓxido de cromo (II)Monóxido de cromoCr203+3Óxido cromosoÓxido de cromo (III)Trióxido de dicromoCr03+6Óxido crómicoÓxido de cromo (VI)Trióxido de cromo<br />EJERCICIOS EN CLASE: forme óxidos básicos con los siguientes elementos<br /> Ca + 02 -><br /> Li + 02 -><br /> Mn + 02 -><br /> Co + 02 -><br /> Ni + 02 -><br /> Sn + 02 -><br /> Pb + 02 -><br /> Bi + 02 -><br /> Au + 02 -><br /> Pd + 02 -><br />ÓXIDOS ÁCIDOS<br />Se forman mediante enlaces covalentes y covalentes coordinados<br />La reacción general es: No M + 02 -> (No Metal)20n<br />El oxígeno, por ser más electronegativo que los no metales (a excepción de flúor), trabaja con número de oxidación negativo (-2) y el no metal, con número de oxidación positivo.<br />Uno de los óxidos ácidos más conocidos es el óxido carbónico, llamado también dióxido de carbono (C02) o gas carbónico, que se produce en la respiración de los seres vivos.<br />EJEMPLOS<br />Si + 02 -> Si204 = Si02<br />2C + 02 -> C202 = 2C0<br />2N2 + 302 -> 2N203<br />FORMULANÚMERO DE OXIDACIÓNNOMBRE TRADICIONALNOMBRE STOCKNOMBRE SISTEMÁTICOCl2 0+1Óxido HipoclorosoÓxido de cloro (I)Monóxido de dicloroCl203+3Óxido clorosoÓxido de cloro (III)Trióxido de dicloroCl205+5Óxido clóricoÓxido de cloro (V)Pentóxido de dicloroCl207+7Óxido PerclóricoÓxido de cloro (VII)Heptóxido de dicloro<br />EJERCICIOS EN CLASE: forme óxidos ácidos con los siguientes elementos.<br /> S + 02 -><br /> S + 02 -><br /> Se + 02 -><br /> Br + 02 -><br /> I + 02 -><br /> As + 02 -><br /> Si + 02 -><br /> N + 02 -><br /> C + 02 -><br /> B + 02 -><br />LOS PERÓXIDOS<br />Son compuestos binarios en los cuales el oxígeno (02-1 ión peróxido) presenta un estado de oxidación -1 y contiene enlaces 0-0.<br />Los metales activos como Na; Ca; Sr y Ba, reaccionan con el oxígeno para formar los peróxidos.<br />La fórmula de los peróxidos no se puede simplificar.<br />Ejemplos: Na2+02-1 = peróxido de sodio; Mg+202-1 = peróxido de magnesio; Ca+202-1 = peróxido de calcio; K2+102-1 = peróxido de potasio.<br />FUNCIÓN ÁCIDO<br />Son sustancias que se caracterizan por liberar iones H+, cuando se encuentran en solución acuosa.<br />Presentan sabor agrio<br />Existen dos clases de ácidos inorgánicos.<br /> <br />ÁCIDOS HIDRÁCIDOS<br />Son compuestos binarios; contienen No Metal + H2 (en estado gaseoso), se nombran como haluros.<br />En solución acuosa se comportan como ácidos, ejemplos:<br />F2(g) + H2(g) -> 2HF(g) Fluoruro de Hidrógeno; si es HF(ac) se le llama Ácido Fluorhídrico.<br />H2 + S -> H2S; se le llama Ácido Sulfhídrico.<br />HIDRUROS<br />EJEMPLO DE HIDRUROS ESPECIALES CON LA FAMILIA (VA)<br />COMPUESTOHIDRURO DE LA FAMILIA (VA)NH3Amoniaco o Trihidruro de NitrógenoPH3Fosfina o Trihidruro de FósforoAsH3Arsina o Trihidruro de ArsénicoSbH3Estibina o Trihidruro de AntimonioBiH3Bismutina o Trihidruro de Bismuto<br />ÁCIDOS OXÁXIDOS<br />Son compuestos ternarios que contienen H-(No metal-0)con # oxidación <br />Se obtienen de la reacción de un óxido ácido + agua -> Ácido; ejemplos:<br />Del Óxido Nítrico: N205 + H20 -> 2H (N03)-1 Se le llama Ácido de Nitrógeno (V) ó Ácido Nítrico<br />Del Óxido Hipocloroso: Cl20 + H20 -> H2Cl202 ->2H (Cl0)-1 Se le llama Ácido de Cloro (I) ó Ácido Hipocloroso.<br />EJERCICIOS<br />Cuando reaccionan el óxido bórico, el óxido hipofosforoso, el óxido fosforoso y el óxido fosfórico con agua, se obtienen varios ácidos dependiendo del número de moléculas de agua que se añada al óxido. Sin embargo, la forma más estable de los ácidos obtenidos, corresponde a la reacción del óxido con tres moléculas de agua:<br />Óxido bórico + agua -><br />Óxido hipofosforoso + agua -><br />Óxido Fosforoso + agua -><br />Óxido Fosfórico + agua -><br />NOMENCLATURA DE LOS IONES POLIATÓMICOS<br />Un ión poliatómico, es un ión que contiene dos o más elementos, consta de uno o más cationes combinados con un ión poliatómico negativo. Ejemplo: K+1(Mn04)-1, el nombre correcto de este compuesto es Permanganato de Potasio.<br />El sufijo no indica la cantidad de átomos de oxígeno presentes, sino depende del número de oxidación del ión. Ejemplo: (S04)-2, indica el ión sulfúrico, para ácido y sulfato para sal; (S03)-2, indica el ión sulfuroso para ácido y sulfito para sal; lo que indica que el ión poliatómico trabaja con (-2).<br />Tabla: Nombre, fórmulas y cargas de algunos iones, para ácidos, sales y bases.<br />NombreFórmulaCargaNombreFórmulaCargaAmonio(NH4)+1Yoduro(I)-1Dicromato(Cr207)-2Carbonato(C03)-2Hipocloroso(Cl0)-1Bórico(B03)-3Bromuro(Br)-1Fosfórico(P04)-3Hidróxido(0H)-1Fosfato(P04)-3Arsénico(As04)-3Nitrito(N02)-1Permangánico(Mn04)-1Nitrato(N03)-1Clorato(Cl03)-1Hiposelenoso(Se02)-2<br />Observe la tabla periódica las familias de los no metales que forman iones poliatómico con el oxígeno van poseer un número determinado de número de oxidación: (III-A) trabaja con (-3); la familia (IV-A) trabaja con (-2); la familia (V-A) trabaja el Nitrógeno con (-1) y los demás trabajan con (-3); la familia (VI-A) quitando el oxígeno los demás trabajan con <br />(-2) y la familia (VII-A) trabaja con (-1).<br />EJERCICIOS EN CLASE<br />Escriba la fórmula de los siguientes oxácidos.<br />Ácido hipocloroso<br />Ácido cloroso<br />Ácido clórico<br />Ácido fosforoso<br />Ácido fosfórico<br />Ácido sulfuroso<br />Ácido sulfúrico<br />Ácido hiposulfuroso<br />Ácido bórico<br />Ácido nitroso<br />Ácido nítrico<br />Ácido hipoyodoso<br />Escriba los nombres, tradicional, stock y sistemático de los siguientes oxácidos.<br />HN02<br />H2S04<br />H2C204<br />H3P03<br />HBr03<br />HCl04<br />HCl0<br />HN02<br />HI<br />HF<br />HBr<br />H2S<br />FUNCIÓN HIDRÓXIDO<br />Los hidróxidos, también llamadas bases, se caracterizan por liberar iones (0H)-1, en soluciones acuosas. Esto le confiere un pH alcalino o básico a las soluciones. Se caracterizan por sabor amargo.<br />La reacción química para obtener hidróxidos = bases, es:<br />Neutralizan los ácidos, cambian el color rojo del papel tornasol a azul y con la fenolftaleína dan color fucsia.<br />Para nombrar los hidróxidos se utiliza el prefijo hidróxido seguido del nombre del óxido del cual provienen; esta norma se aplica en las tres nomenclaturas: Tradicional, stock y sistemática; por ejemplo: Na0H proviene del óxido de sodio, luego su nombre es hidróxido de sodio, tradicional; stock: hidróxido de sodio (I); sistemático: hidróxido de sodio.<br />FÓRMULANOMENCLATURA TRADICIONALNOMENCLATURA STOCKNOMENCLATURA SISTEMÁTICAFe(0H)2Hidróxido ferrosoHidróxido de hierro (II)Dihidróxido de hierroAu(0H)3Hidróxido áuricoHidróxido de oro (III)Trióxido de oroSr(0H)2Hidróxido de estroncioHidróxido de estroncio (II)Dihidróxido de estroncio<br />EJERCICIOS EN CLASE<br />Escriba la fórmula de los siguientes compuestos<br />Hidróxido férrico<br />Hidróxido ferroso<br />Hidróxido estánico<br />Hidróxido estanoso<br />Hidróxido cálcico<br />Hidróxido sódico<br />Hidróxido de bario<br />Hidróxido de calcio<br />Hidróxido de magnesio<br />Hidróxido de potasio<br /> Hidróxido Plúmbico<br />Hidróxido maercurioso<br />Escriba el nombre de los siguientes compuestos.<br />Ba(OH)26. Pb(0H)411. Cr(0H)6<br />Ni(0H)27. Pb(0H)212. Cr(0H)3<br />Ni(0H)38. Hg(0H)2<br />Ag(0H)9. Hg(0H)<br />Zn(0H)210. Cr(0H)2<br />SALES<br />SALES HIDRÁCIDAS<br />Nomenclatura: Se nombran con la terminación (URO), ejemplo, el Cloruro de Calcio o cálcico (CaCl2); el No Metal siempre va a trabajar con el menor número de oxidación, como lo vemos en el (Cl), el cual trabaja con (-1,-3,-5,-7),en esta fórmula trabaja con (-1). El metal puede trabajar con los números de oxidación que posee: el (Ca) solo posee (+2). Si el metal posee dos números de oxidación, el de menor # de oxidación terminara en (oso), y el mayor en (ico). Ejemplo el hierro (Fe), que trabaja con (+2,+3).<br />SUFIJO DEL ÁCIDOSUFIJO DE LA SAL________hídrico_________uroHipo______ osoHipo_____ ito__________ oso_________ ito__________ ico_________ atoPer_______ icoPer______ ato<br />Reacción química: Ácido Yodhídrico + Hidróxido de Potasio produce una sal que es el Yoduro de Potasio más agua: HI + K0H -> KI + H20.<br />EJERCICIOS. Escriba la fórmula correcta.<br />Fluoruro Férrico<br />Yoduro Hipocromoso<br />Seleniuro Niquelico<br />Carburo Estánico<br />Nitruro Cálcico<br />Escriba los nombres correctos y las reacciones químicas para las siguientes sales:<br />HBr + Cu(0H)2 -><br />HCl + Mg(0H)2 -><br />H2S + Ni(0H)2 -><br />H2S + Ni(0H)3 -><br />HF + Cr(02 -><br /> SALES NEUTRAS = SALES OXÁCIDAS<br />Al formarse, todos los hidrógenos del ácido y todos los hidroxilos de la base reaccionan completamente hasta neutralizarse.<br />Fórmula general es: <br />EJEMPLOS:<br />2H3P04 + 3Ca(0H)2 -> Ca(P04)2 + 6H20<br />3H2S04 + 2Al(0H)3 -> Al2S04 + 6H20<br />EJERCICIOS. Escriba los nombres químicos de las siguientes fórmulas:<br />Cu3(P04)24. Au2(S04)3<br />Cu3P045. Sn(N03)2<br />Au2S03<br />Escriba las fórmulas de las siguientes Sales Neutras:<br />Yodato Plúmbico<br />Yodito Plumboso<br />Fosfito de Plata<br />Fosfato Hipocromoso<br />Perclorato Estroncico<br />SALES ÁCIDAS Y BÁSICAS<br />Bicarbonato de sodio<br />Sulfato ácido de potasio<br />Fosfato diácido de Litio<br />Hidroxo doble de Sodio y Potasio.<br />Hidroxocloruro de Magnesio<br />CaN03(0H)<br />H.MT-2011<br />
