1a. UNIDAD: Materia energía y estructura del átomopdf - copia
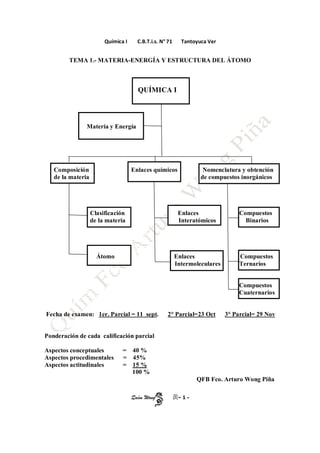
- 1. Química I C.B.T.i.s. N° 71 Tantoyuca Ver TEMA 1.- MATERIA-ENERGÍA Y ESTRUCTURA DEL ÁTOMO QUÍMICA I Materia y Energía Composición de la materia Enlaces químicos Clasificación de la materia Nomenclatura y obtención de compuestos inorgánicos Enlaces Interatómicos Enlaces Intermoleculares Átomo . Compuestos Binarios Compuestos Ternarios Compuestos Cuaternarios Fecha de examen: 1er. Parcial = 11 sept. 2° Parcial=23 Oct 3° Parcial= 29 Nov Ponderación de cada calificación parcial Aspectos conceptuales Aspectos procedimentales Aspectos actitudinales . . = 40 % = 45% = 15 % 100 % QFB Fco. Arturo Wong Piña Quím Wong -1-
- 2. Química I C.B.T.i.s. N° 71 Tantoyuca Ver I.- INTRODUCCIÓN A LAS CIENCIAS QUIMICAS Competencia.- Definición, divisiones, subdivisiones, y periodos de la Química 1).- Definición de Química. Es la Ciencia* que estudia la materia; ü en su composición (tiene elementos, compuestos y mezclas) , ü en su estructura ; molecular, atómica, iónica, y subatómica , ü en sus propiedades o características físicas, ü en sus cambios que son las reacciones que experimenta como reactivos para transformarse en productos, por efecto de la energía interna y externa. Cambio es sinónimo de fenómeno. Diferenciar los fenómenos físicos de los químicos *Ciencia.- Es el conjunto de conocimientos ciertos, comprobables y sistemáticamente organizados que explican algo del universo. Obtenidos mediante la metodología ( método científico ): 1°)Observación-Investigación, 2°)Hipótesis, 3°) Experimentación, 4°)Teoría y 5°) ley I.- Química General: Estudia conceptos, teorías y leyes elementales. QUÍMICA II.- Química descriptiva.- Estudia las características, propiedades , . composición y clasificación de las sustancias, sus reacciones y los . métodos industriales o de laboratorio de obtención. Se divide en : A) Química inorgánica.- Estudia metales y no metales y los compuestos que producen. B) Química orgánica.- Estudia las sustancias que tienen átomos de carbono como estructura fundamental de sus moléculas . Ambas se complementan con la Química Analítica.- Ciencia que estudia los procedimientos para identificar y cuantificar los componentes ( analitos ) de las muestras de materia, por lo que se subdivide en : 1) Química analítica cualitativa.- Identifica cuales son las sustancias contenidas en las muestras de materia. Para después separarlas y purificarlas. 2) Química analítica cuantitativa.- Determina las cantidades de analitos contenidas en las muestras de materia; ya sea en peso (Gravimetría) o en volúmen (Volumetría). 3).- Algunas Ciencias derivadas de la relación de la Química con otras Ciencias. Ejemplos: Fisicoquímica , Termoquímica, Cinética Química, Cristaloquímica, Electroquímica, Fotoquímica, Radioquímica, etc.) Bioquímica , Química Biomolécular, Quím Wong -2-
- 3. Química I C.B.T.i.s. N° 71 Tantoyuca Ver etc., Química Enológica, etc., Química Farmaco-biológica.,Química de Superficie, Química Industrial; Química de los Plásticos, Metalúrgica , Química de los Colorantes, Química Petrolera etc, 4.- Una de las clasificaciones de los periodos o etapas de la Química, es la siguiente: I).- EL PERIÓDO ANTIGUO DE LA QUÍMICA.- ( De AC al año aprox. 300 D C ) . Los Egipcios ya trabajaban el oro, plata, vidrio, colorantes, sustancias ebalsama-doras, etc . Los Chinos; la pólvora, tintas, lacas, la seda, porcelana, etc.. La constitución de la materia para Empódecles es de: Tierra, Agua, Aire y Fuego. Aristóteles le aumentó : Húmedo, seco, frío y caliente. Para Leucipo y Demócrito de Abdera, la materia es un conjunto de Átomos. A ( Sin ), Tomos (cortes o divisiones), que consideraban como las partículas más pequeñas de la materia imposibles de dividirse o fraccionarse más. 2).- EL PERIÓDO DE LA ALQUIMIA.- Del año 300 al 1550. De Alchemia, o Chemia , que significa arte y ciencia de los Egipcios. Figuró Alberto Magnus y Roger Bacon por buscar la pierdra filosofal , Quinta essentia o Magisterium algo que convirtiera cualquier metal común en oro. Si descubren muchos ácidos y bases, la destilación, la aleación de metales, algunos elementos y propiedades de muchos compuestos. 3) PERIODO DE LA IATROQUÍMICA.- Mas o menos del 1550 al 1650. En el que se buscó el elixir de la vida , preparación que curara todas las enfermedades y confiriera el don de la eterna juventud. PARACELSO, médico suizo, si descubrió sustancias con propiedades curativas 4) PERIÓDO DEL FLOGISTO ( 1650-1775).- Se investiga el fenómeno de la combustión. El alemán Georg Ernest Sthal creía que las sustancias tienen flogisto y que al arden se desflogistan . 5) PERIÓDO DE LA QUÍMICA MODERNA ( 1775 1900 ) De la generación de los sabios que enuncian y comprueban la mayor parte de las LEYES FUNDAMENTALES DE LA QUÍMICA : Lavoisier, , Sceele, Priestly, Cavendish, Dalton, Prust, Gay Lussac, Berzelius, Mendeleef, Wohler, etc, etc. 6) PERIÓDO DE LA QUÍMICA CONTEMPORÁNEA. Digamos, de 1900 a la fecha. Sobresaliendo la Era atómica y la Nanoquímica. Frederick Sanger fué dos veces laureado con el Premio Nobel de Química, cuarta persona del mundo en recibir dos premios Nobel (los tres anteriores fueron Marie Curie, Linus Pauling y John Bardeen), determinó la secuencia de los aminoácidos de la insulina en 1955, precursor del proyecto del genoma humano.( Su segundo Premio Nobel en 1980) Actividad: Investigar 6 premios Nobel en Química y sus aportaciones, de 1900 a la fecha. Quím Wong -3-
- 4. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 2.- Competencia.- Materia y Energía; Definiciones, Clasificaciones, Leyes, Unidades e Inter-conversiones de la Materia y la energía . 2.1.- Concepto de materia.- Es todo aquello que posee cuatro propiedades relativistas; masa, energía, espacio y tiempo. 2.2.- Concepto de Energía .- Es la fuerza o agente del cambio o transformación de la materia. Es la cantidad de trabajo que un sistema físico es capaz de producir. 2.2.1.-Unidades de energía ü La caloría es la cantidad de energía necesaria para elevar la temperatura de un gramo de agua de 14,5 a 15,5 grados centígrados. ü 1 julio = 0.24 calorías. ü 1 vatio o watt ( W) es igual a 1 joule (julio) sobre segundo (1 J/s ü El amperio o ampere (símbolo A), es la unidad de intensidad de corriente eléctrica ü El culombio.- Es la unidad de carga, desplazada por una corriente de un amperio en el tiempo de un segundo. ü La Caloría grande ( Cal ) .- Unidad manejada en Alimentación y Nutrición. 1 Cal = 1 kcal = 1000 cal = 4184 J = 4.184kj. 2.3.- Clasificaciones de los tipos de Energía. Las formas básicas de la manifestación de la energía, son las siguientes: Energía cinética La Energía Mecánica Energía potencial La Energía Mecánica se clasifica en energía cinética y energía potencial, y de ésta se derivan todos los demás tipos o manifestaciones. Energía cinética.- Es la que posee todo cuerpo en virtud de su movimiento. Energía potencial.- Es la que posee todo cuerpo en el estado de reposo en virtud de su ubicación en el eje tridimensional del espacio de un campo de fuerzas. Energía potencial gravitatoria y la energía potencial elástica. Potencia.- Es la cantidad de trabajo realizado en un determinado tiempo. Ejemplos de manifestaciones de la Energía: Energía Química, Energía Térmica o calorífica, Energía Nuclear de Fusión y Energía Nuclear de Fisión, Energía Hidráulica, Energía Eólica, Energía Eléctrica, Energía Radiante (O por oscilación de un campo magnético y eléctrico ), solar etc.. Investigar.- Energía nuclear de fisión y energía nuclear de fusión. Producción de energía con biomasa. Fuentes alternativas de energía no contaminante, limpia, Quím Wong -4-
- 5. Química I C.B.T.i.s. N° 71 Tantoyuca Ver . 2.4.- Clasificación de la energía radiante, de mayor a menor longitud de onda ENERGÍA RADIANTE Longitud de onda ( ) Ondas de radio y 2x106 a 3x10 2 cm TV Rayos Infrarrojos 3x10-2 a 7x10 5 ( RI ) cm Luz Visible 7x10-5 a 4x10 5 cm Fuente Aplicaciones Válvulas electrónicas Cuerpo emisor de calor Cuerpos muy calientes Radio, tv, radar Casa solar Iluminación del sol, flama, focos, gases ionizados 4x10-5 a 5x10 7 igual Desinfectante cm 5x10-7 a 1x10 9 Los rayos Placas de RX cm catódicos Rayos Gamma 1x10-9 a 1x10 12 Radiactividad de Cancer cm isótopos Trabajo; Investigar espectro de la luz visible, sus longitudes de onda y los colores correspondientes Luz Ultavioleta ( UV) Rayos X 2.5.- Ejemplo de la transformación de la energía de un tipo a otro tipo: Los transductores son dispositivos que transforman un tipo de energía en otros tipos. Por ejemplo: Los micrófonos y altavoces son transductores acústicos que transforman la energía acústica o sonora en energía eléctrica, y viceversa. Otro ejemplo de inter-conversión energética: La energía química de la gasolina o del etanol, puede convertirse en energía térmica en los cilindros de los pistones de una motor y ésta en la energía mecánica que mueve al automóvil 2.6.- Leyes de la materia y la energía Ley de la conservación de la masa-energía.(De Albert Einstein) La cantidad de masa-energía que se manifiesta en un determinado espacio y tiempo del Universo, es constante . Ecuación de Einstein E=m.c2 m = masa. c = velocidad de la luz. velocidad = Espacio recorrido/tiempo En el universo la masa se convierte en energía y la energía en masa. Ley de la conservación de la materia. ( De Lavoisier ).- La materia no se crea ni se destruye, solo se transforma. Quím Wong -5-
- 6. Química I C.B.T.i.s. N° 71 Tantoyuca Ver . Ley de la conservación de la Energía: La energía no se crea ni se destruye solo se transforma. Un tipo de energía se transforma en otro tipo de energía pero también puede convertirse en masa y visceversa. 2.6.- Clasificación de la materia: Materia Inorgánica . 1) Por su naturaleza . Materia Orgánica 2) Por su composición Química Elementos Compuestos Mezclas . . 3) Por su sistema físico . Materia Homogénea.- Homo=igual (a la vista ) Ej: Elementos, compuestos y mezclas homogéneas ( disoluciones químicas como el agua acidulada ) Materia Heterogénea.- Hetero= diferente (a la vista) Ej: Las mezclas heterogéneas, se le distinguen fases. 4) Por su estado de agregación molecular: Materia en estado sólido, en estado líquido y en estado gaseoso Características diferenciales de los tres estados principales de la materia Estado de Agregación 1)Volumen 2)Forma 3)Compresibilidad 4)Atracción entre Moléculas . 5).Por su pureza . . . Sólido Definido Definida Incompresible Intensa Líquido Definido Indefinida Incompresible Moderada Gas Indefinido Indefinida Compresible Despreciable LA MATERIA PURA.- Son los elementos y los compuestos. Ej: El Elemento sodio y el elemento Cloro al unirse forman el compuesto cloruro de sodio(NaCl ) que conocemos como sal de cocina . MATERIA IMPURA.- Las mezclas homogéneas y heterogéneas. Ejemplo; coca cola, limonada, Agua con alcohol, agua con arena, etc.. Quím Wong -6-
- 7. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 3.- COMPETENCIA.- CLASIFICA Y DEFINE LAS PROPIEDADES FÍSICAS DE LA . MATERIA 3.1.- Propiedades físicas de la materia, intrínsicas y extrínsicas. Propieda des Físicas de la Materia Propiedades extensivas o generales Son las que varían según la cantidad de materia Peso Volumen Longitud Inercia Impenetrabilidad Dilatibilidad Punto de fusión Punto de ebullición, punto de congelación. Densidad PropiedaCoeficiente de solubilidad des Indice de refracción intensivas Organolépticas:Color,Olor o Sabor. específicas Son independientes de la Opacidad/Transparencia Trabajo; cantidad de materia. Son las Forma,Textura y consisInvestigar tencia. características de cada la definición Estado de agregación sustancia. de c/u de las molecular (sólido, líquido ó Son como las huellas propiedades gas). dactilares, exclusivas y físicas y Rigidéz, Dureza, Brillo únicas para cada sustancia metálico. Maleabilidad, que instrumento por lo que sirven para Ductilidad, Elasticidad. s de identificarlas. Básicas en la Densidad, Solubilidad, medición se Viscocidad, Adsorción Química Analítica utilizan para Presión de vapor, Cualitativa. medirlas. Tensión superficial. Ïndice de refracción, Rotación específica. Calor específico. Peso atómico Peso molecular Quím Wong -7-
- 8. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 4.- Competencia: Conceptualiza propiedades químicas de la materia y . da ejemplos 3 ejemplos de reacciones tipo.. Son las reacciones químicas, que puede tener cada tipo de substancia, llamándosele reactivo de manera que se transforman en sustancias llamadas productos que se caracterizan por tener propiedades específicas diferentes a las iniciales. . ejemplos: 4.1.- HIDRÓXIDO + SAL HIDRÓXIDO + SAL a) Si el Hidróxido de sodio reacciona con el sulfato ferroso, forma el hidróxido ferroso que se distingue por ser un precipitado verde parduzco ) más sulfato de sodio en solución 2 NaOH (aq) + FeSO4 (aq) Fe(OH)2 verde + Na2SO4(aq) b) Pero si el hidróxido de sodio reacciona con el sulfato cúprico entonces formará Hidróxido cúprico (precipitado azul) y sulfato de sodio en solución.. 2 NaOH (aq) + 4.2.- ACIDO CuSO4 (aq) + Cu(OH)2 HIDROXIDO azul SAL + + Na2SO4(aq) AGUA A la reacción entre un ácido y una base se le llama reacción de Neutralización. Importante en el Laboratorio de Análisis, en las Titulaciones o Valoraciones ácidobase. Ejemplos: H2SO4 + 1n de ác. sulfúrico H3PO4 4.3.- SAL Na2SO4 2n Hidróxido de sodio + 2n Ác. Fosfórico 2 NaOH 3 Na(OH)2 3n Hidróxido de Sodio + AgNO3(ac) + Na3 PO4 1n Fosfato de sodio SAL HCl(ac) AgCl 1n Nitrato de plata 1n Ácido Clorhídrico + 1n de Sulfato de sodio + 2 H2O 2n de agua H2O 6n de Agua + + 1n Cloruro de plata HNO3(ac) 1n Ácido nítrico Nota: n significa moles. Una mol tiene el peso de su molécula expresado en gramos. Trabajo: Investigar y explicar cómo se determina el peso de una n de H2SO4 y de una n de H3PO4 Quím Wong -8-
- 9. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 3.3.- Competencia: Mediante un diagrama describe los cambios físicos que puede tener la materia en su estado de agregación molecular, cuando cambia la energía y/o la presión de sus condiciones. El incremento de temperatura va aumentando la energía cinética de las partículas de la materia lo que va aumentando su separación y por ende su estado de agregación. Solidificación Licuefacción Ionización Desionización . 1.-SÓLIDO 2.- L Í Q U I D O Fusión 3.- GAS ó 4.- PLASMA vaporización Condensación Sublimación 5.- CONDENSADO . DE BOSE-EINSTEIN 3.- VAPOR Contenido de energía o Entalpía Incremento de la entalpía Disminución de la entalpía 1.- Materia en estado sólido. Se forma cuando la fuerza de atracción de las moléculas es mayor que las de repulsión. Las moléculas se quedan fijas y el movimiento energético se queda limitado a una vibración despreciable . Al incrementarse su temperatura, su vibración será mayor. 2.- Materia en estado líquido. Se forma cuando la temperatura rompe la fijación de las moléculas del estado sólido. Sus moléculas pueden moverse más separadas que en la estructura sólida. Los líquidos son de forma indefinida pero al adecuarse a su contenedor tienen la forma definida al contenedor y por lo tanto un volumen definido. Quím Wong -9-
- 10. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 3.- Materia en estado gaseoso.Es un estado de la materia en el que se le puede comprimir y al disminuirle su volumen aumenta su densidad . Sus moléculas tienen mayor movimiento que las del estado líquido pero es menor su fuerza atracción, por lo que se mueven a cualquier dirección ocupando TODO el espacio disponible de su contenedor. 4.- Materia en estado plasmático.Los plasmas son unos gases ionizados de temperatura muy elevada. Debido a la alta temperatura las moléculas se separan y sus átomos se convierten en un gas de iones altamente cargados (plasma) . La mayor parte del universo visible se encuentra en estado de plasma. Algunos ejemplos de materia en estado de plasma son las estrellas (por ejemplo el Sol), el fuego, los tubos fluorescentes, la aurora boreal, los rayos durante una tormenta, los producidos artificialmente por ejemplo para las pantallas de TV de plasma, el interior de los reactores de fusión, etc.. A medida de que la temperatura de la materia aumente, aumenta el movimiento (CINÉTICA) de las moléculas es mayor, y a la inversa ocurre exactamente lo mismo. Existe un mínimo, el cero absoluto (0 Kelvin = -273,15 grados Centígrados). En ese límite llegamos a un punto dónde todo movimiento molecular de la materia se detiene. Algunos científicos han logrado llegar a enfriar materia a una temperatura muy cercana al cero absoluto, pero nunca han llegado al punto exacto. El problema es que para ver la materia se necesita luz (energía ), y la luz necesaria para visualización le transfiere energía a la materia y le aumenta la temperatura y por consiguiente le aumenta el movimiento molecular, no permitiendo el punto cero Kelvin, los -273.15°C 5.- Materia en el estado condensado de Bose-Einstein.- Este estado lleva el nombre de los que predijeron su existencia, Satyendra Nath Bose y Albert Einstein en 1922. Fue obtenido en 1995 por los físicos Eric Cornell, Wolfgang Ketterle y Carl Wieman, logro que les valió el Premio Nobel de Física en el año 2001. El condensado de BoseEinstein se consigue a temperaturas muy cercanas al cero absoluto, es un estado en el que los átomos se superponen entre sí, es decir, todos muy justitos o apretaditos en el mismo espacio. Se trata de un estado de coherencia cuántica macroscópico. Quím Wong - 10 -
- 11. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 4.- Competencia.- Menciona 4 de las características diferenciales que distinguen las Mezclas, Compuestos y Elementos, como materia, en lo referente a; su composición, las uniones o enlaces químicos, nomenclatura y energía de formación. Características 1.- Composición 2.- Uniones 3.- Nomenclatura MEZCLA Materia de composición indefinida. Depende de qué y como se quiera preparar. Ejemplo: Un pastel . De sustancias con uniones aparentes, débiles. Que se les puede separar mediante simples métodos físicos: Filtración, Destilación, Decantación.. Ej. Agua con sal separable por evaporación del agua. De nombres que no se apegan a ningunas reglas o normas. Algunas son disoluciones , coloides y suspensiones . 4.- Energía No requiere una energía definida para su formación. 5.- Peso No tiene un peso definido para su formación COMPUESTO Materia de composición definida. Por leyes estequiométricas: De 2 elementos= Binarios. De 3 = Ternarios . Sus uniones son: De uniones Enlaces químicos átomo-átomo fuertes; De que son iguales elemento-elemento en su número de de tipo iónico o electrones (e-) y covalente, que de igual número forman moléculas de protones( p+ ). que sólo se pueden Uniones que son separar por enlaces metálicos métodos químicos ó enlaces covalentes. Sus nombres se apegan a la nomenclatura de la UIPAC. Ejemplo: Óxidos, Hidruros, Ácidos, Hidróxidos, Sales etc. Sus nombres son derivados del Latín o griego Actividad: Enlistado de los elementos por grupos ver Tabla Periódica. Sí requiere de una energía definida para que se unan elemento-elemento. Tiene un peso definido estequiométricamente cada mol de ésta sustancia . Actividad.- Informarse Sí requiere de una energía definida para que se unan átomo-átomo Tiene un peso definido en cuanto el peso atómico (A) de todos sus átomos, pues son iguales. A = Z+n° cómo se determina el valor de una mol de un compuesto, con ejemplos. Quím Wong ELEMENTO Materia de composición definida. De una sola sustancia pura, que es la más sencilla. - 11 - Z = peso d protones n° = peso neutrones
- 12. Química I C.B.T.i.s. N° 71 Tantoyuca Ver Actividad.- Presentar información de 4 de los métodos del laboratorio de separación de los componentes de una mezcla, su fundamento y procedimiento. 5.- COMPETENCIA. Da los conceptos de mezcla, de sistemas dispersos, clasificación de las mezclas por sus fases y clasifica los sistemas dispersos (disoluciones, coloides y suspensiones ) de acuerdo a sus características y tamaño de las partículas. Conceptos. 1. MEZCLA Es la unión de dos o más sustancias, con la característica que no requieren de alguna reacción química, solo de reacciones físicas para su unión aparente, por lo cual se facilita la separación de sus componentes por simples métodos físicos. 2. SISTEMAS DISPERSOS Podemos definir un sistema disperso o dispersión como la difusión de una o más sustancias en el seno de otra. A la o las que se difunden se le nombra fase dispersa generalmente son poca proporción. A la sustancia que recibe en su seno y dispersa se le llama fase dispersante. 3. CLASIFICACIÓN DE LAS MEZCLAS POR SUS FASES . . .. . . . Tipos de mezclas por sus fases . . . . . A) La mezcla homogénea. Homo = Significa Igual. Es la que muestra aspecto de una sola fase. En todo su cuerpo se le ven las mismas características físicas. etc. Aunque tenga numerosos componentes. Ejemplo: De Fase dispersante =Agua. De Fase dispersa=3 sales solubles: NaCl, NaNO3 y KNO3 La disolución del agua con estas sales es una mezcla monofásica porque es la apariencia que da a la vista, porque las sales de este ejemplo, no reaccionan químicamente y se mantienen dispersas en el dispersante(Agua). B) La mezcla heterogénea. Hetero = Significa diferente. A ésta mezcla se le ven a simple vista 2 o más fases, por ejemplo: Las suspensiones, Melox son mezclas heterogéneas Quím Wong - 12 -
- 13. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 6.- Competencia.- Describe las mezclas en TIPOS DE DISPERSIONES QUÍMICAS, sus características, y el tamaño de sus partículas Tipo de dispersión 1).-SOLUCIONES ( dispersiones homogénea ) 2).- COLOIDES 3).-SUSPENSIONES ( Dispersiones heterogéneas ) Características Tamaño de las partículas dispersas o Sus partículas dispersas NO sedimentan. o Pueden atravesar papeles filtro y membranas o No se ven ni al microscopio. o Son traslúcidas aunque sean coloridas o no 1)Sus partículas dispersas se sedimentan por centrifugación, 2) pasan el papel filtro, pero NO atraviesan las membranas , 3)Se ven solo algunas partículas especiales al microscopio. 4) Si les incide un rayo de luz producen el efecto de Tyndall 5) Tienen movimiento Browniano. Ejemplos de coloides de los Organismos vivos: sangre, protoplasma etc . Otros ejemplos: Aerosoles, Soles o Gelatinas, Emulsiones: Leches, Quesos, mayonesas, pinturas, jaleas, champús, etc . ü Se SEDIMENTAN con el simple reposo, agítese antes de usarse ü De 1 a 10 A de diámetro. ü Son especies moleculares o bien especies iónicas. De 10 a 2000 A de diámetro Ejemplos de coloides: Pintura, Gelatina, Leche, Mayonesa ,Queso, Mantequilla , La crema batida, Espuma para afeitarse Los tejidos vivos, Lubricantes. De más de 2000 A, ü NO pasan el papel filtro, ni las membranas, ü Son visibles a simple vista ü No dispersan la luz. Por ejemplo agua con cal, melox 1 A = Una diez mil, millonésima parte de 1 metro. Quím Wong 0.1nm = 1 A = 100 pm - 13 -
- 14. Química I C.B.T.i.s. N° 71 Tantoyuca Ver II.- EL ÁTOMO. 1. Eventos y personajes sobresalientes en el descubrimiento del átomo y sus partículas. 2. Modelos atómicos. 3. Principios que fundamentan el modelo atómico cuántico ondulatorio: 1) Principio de Louis de Bröglie. 2) Principio de incertidumbre de W. Heissenberg. 3) Principio de exclusión de W . Pauli. 4) Principio de máxima multiplicidad de Friedrich Hund. 5) Principio de edificación progresiva ó Auf Bau Prinzip. 4. Los cuatro números cuánticos, sus valores y representación 5. Formas de los orbitales en los ejes tridimensionales delespacio. 6. Las configuraciones electrónicas de los elementos, representadas por el método de notación s,p,d,f. y por el método de diagramas de cajas de orbitales. 7. Configuraciones electrónicas especiales de los elementos de Transición. 8. Configuraciones electrónicas especiales del: CROMO, MANGANESO, FIERRO, COBALTO, NIQUEL Y COBRE. 9.- Configuraciones especiales de : Elementos: 59Gd al 63Eu, Elementos con terminación: 4fn,6s2, Elementos con terminación: 5d,6s, Elementos con terminación 4f,5d,6s,6p, Elementos con terminación 6d,7s Elementos del 71Lu al 80Hg, terminación 5f,6d,7s 10.- Paramagnetismo y Diamagnetismo Quím Wong - 14 -
- 15. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 7.-Competencia: De manera breve menciona los eventos y personajes más sobresalientes para el descubrimiento del átomo y sus partículas. UNIDAD I.- EL ÁTOMO 1.- EVENTOS Y PERSONAJES RELACIONADOS CON EL CONOCIMIENTO DEL ÁTOMO Y SUS PARTÍCULAS . 01.- LEUCIPO Y DEMÓCRITO DE ABDERA 450 A.C.. Le dieron nombre de átomo A , que significa , sin y Tomo; división. A la fracción más pequeñísima de materia que supusieron ya no es fraccionable, A , que significa sin y tomo; división. I.- El descubrimiento de la electricidad condujo al descubrimiento del átomo y su divisibilidad. 02.- TALES DE MILETO (600 AC).- Descubrió el fenómeno de electrización por frotamiento, al frotar un pedazo de ámbar. El ámbar, ( en griego = electrón ) , es la única "piedra" semipreciosa de origen vegetal , resina vegetal fosilizada proveniente de restos de coníferas y algunas angiospermas, que escurre sobre la corteza de troncos y ramas. Electrización es el efecto de ganar o perder electrones, producido por un cuerpo cuyos átomos son eléctricamente neutros. Se produce : 1. Por contacto: Se puede cargar un cuerpo neutro con solo tocarlo con otro previamente cargado. En este caso, ambos quedan con el mismo tipo de carga, es decir, si se toca un cuerpo neutro con otro con carga positiva, el primero debe quedar con carga positiva. 2. Por frotamiento: Al frotar dos cuerpos eléctricamente neutros (número de electrones igual al número de protones del átomo , ambos se cargan, uno con carga positiva y el otro con carga negativa. La electricidad estática es un fenómeno que se debe a una acumulación de cargas eléctricas en los átomos de un objeto. Esta acumulación puede dar lugar a una descarga eléctrica cuando dicho objeto se pone en contacto con otro. 03.-WILLIAM GILBERT (1660), experimentó la electrostática y el magnetismo de los átomos , aplicó el término de electricidad e ideó el primer electroscopio. Para Benjamín Franklin (1750)), la electricidad es el 'fluido ' o 'fuego eléctrico' de un cuerpo a otro en la descarga, enunció el Principio de conservación de la electricidad. E ideó los términos de electricidad positiva(+) y negativa(-). Quím Wong - 15 -
- 16. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 04.- ALESSANDRO VOLTA (1800), ideó la 1er pila eléctrica o voltaica. La unidad de fuerza electromotriz lleva el nombre de voltio en su honor. Las pilas consisten en dos electrodos metálicos sumergidos en un líquido, o bien en un sólido o pasta que se llama electrolito , que es un conductor de iones. Cuando los electrodos reaccionan con el electrolito, el electrodo ánodo produce electrones (oxidación), y en el otro, el cátodo se produce defeciencia de electrones (reducción). Cuando los electrones sobrantes del ánodo pasan al cátodo a través de un conductor externo a la pila, se produce la corriente eléctrica. II.- El descubrimiento del electromagnetismo condujo al descubrimiento del átomo y su divisibilidad. 05. HANS CHRISTIAN ØRSTED (1820) descubrió que el fenómeno magnético estaba ligado al eléctrico. Inspirando los desarrollos posteriores de A. Ampere y Faraday. 06. JAMES CLERK MAXWELL (1861), formuló las leyes clásicas del electromagnetismo. Demostró que la electricidad, el magnetismo y hasta la luz, son manifestaciones del mismo fenómeno: del campo electromagnético. Su trabajo sobre electromagnetismo ha sido llamado la "segunda gran unificación en física", después de la primera llevada a cabo por Newton. 07.- FARADAY ( 1831 ), descubrió que un conductor eléctrico, moviéndose en un campo magnético generaba una diferencia de potencial y así una pequeña corriente continua ( generadores de electricidad ). El dínamo fue el primer generador eléctrico apto para un uso industrial 08.- HEINRICH GEISSLER (1850) inventó tubos capaces de emitir luz de diferentes colores cuando se les hace una descarga eléctrica en su interior. Son tubos al vacío, cargados de gases en condiciones de baja presión (Los famosos Tubos de Geissler ).Ahora se utilizan para anuncios luminosos. Y hasta hace poco en los TV normales para producir las imágenes. 09.- THOMSON (1897), Experimentó descargas eléctricas con un de tubo mejorado, al vacío con un poco de gas a baja presión; el Tubo de Crookes . Descubrió que las descargas eléctricas son rayos de partículas que se proyectan en línea recta desde el cátodo o polo negativo hasta el ánodo que es el polo positivo ( que éste las atrae por su deficiencia de electrones) por lo que los llamó rayos catódicos .Descubrió que poseen masa y carga eléctrica negativa. Y determinó el valor de la relación entre la carga e y la masa m del electrón, que hoy día se acepta como: = 1.76x108 Coulombs/g O bien 1.76 x 1011 C/Kg Quím Wong - 16 -
- 17. Química I C.B.T.i.s. N° 71 Tantoyuca Ver Actividad.- Obtenga imágenes o esquemas de los experimentos de Thomson de las descargas eléctricas de 20 mil a 100 mil voltios, que realizó en el tubo de Crookes ; un tubo al vacío que tiene un ánodo y dos cátodos., cargado con poco gas a baja presión. Que represente lo siguiente: 1 .Descarga que muestra que el cátodo ( Polo negativo ) produce rayos que se propagan en línea recta al Ánodo ( Polo positivo) que los recibe. Lo que comprueba que estos rayos catódicos son partículas de carga eléctrica negativa . Y si se impactan en una pantalla fluorescente del fondo del tubo, producen energía (luminiscencia y fluorescencia ) 2.- Que si se interpone a los rayos una figura metálica se producen su sombra en la pantalla y energía térmica: Comprueba así que las partículas negativas tienen masa 3.- Que si se interpone entre los rayos un objeto como rehilete; este se mueve ( Energía mecánica). Lo que comprueba que son partículas que poseen masa. 4.- Que si se le rodea de un campo eléctrico en un lado el positivo y en otro el negativo, entre la línea de rayos un campo eléctrico, su trayectoria se desvía hacia la región positiva: Polos iguales se rechazan polos contrarios se atraen. 5.- Que cuando se le sobrepone un campo magnético, lo rechazan desviándose según varíe la intensidad del campo, hacia el polo norte del campo magnético. (regla de la mano derecha). George Johnstone Stoney (1894), bautizó estas partículas de carga negativa como electrones; partículas elementales de la electricidad, o como cargas eléctricas elementales. Thomson descubrió los electrones, su velocidad y su relación carga/masa, en base a las 3 magnitudes que conoció: v La magnitud del ángulo de desviación de los rayos catódicos en función de la intensidad del campo eléctrico aplicado. v La magnitud del campo eléctrico que desvía los rayos catódicos en un ángulo determinado v La magnitud del campo magnético que se requiere para anular el ángulo de la desviación de los rayos catódicos. Joseph John Thomson ü Descubrió las partículas de carga eléctrica negativa del átomo; los electrones. ü La Velocidad de los electrones = 3 x 107 m/seg 30 000 000 metros por segundo ü y su relación Carga/Masa; Q/M = 1.76 x 108 Coulombs/g Actividad.- Exponer la Biografía de Joseph John Thomson Quím Wong - 17 -
- 18. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 10.- ROBERT A. MILLIKAN (1909 y 1913) con su experimento de la gota de aceite descubrió la carga(Q) eléctrica del electrón, que Q =1,6x10-19 Coulombs. RELACIÓN MILLIKAN/THOMSON.- La masa del electrón se determina dividiendo el valor de la carga eléctrica descubierta por Millikan entre el valor de la relación carga/masa descubierta por Thomson. = 1.76x108 Coulombs/g Masa = Masa del electrón = 1.6x10-19 Coulombs. . 1.76 x108 Coulombs/g . / Masa del electrón = 9.11 x 1011 g 11.- EUGEN GOLDSTEIN .- Descubrió los protones en un tubo de Crookes con el cátodo perforado en canales y conteniendo gas Hidrógeno: Observó que el Ánodo ( electrodo positivo) emite rayos anódicos que viajan desde el ánodo, hasta atravesar las perforaciones o canales del cátodo, dando lugar a una luminiscencia en la zona posterior de este. Por lo que se dedujo que son partículas positivas (+) que son cationes (H+) del gas hidrógeno, denominando a su flujo rayos canales y a sus partículas; protones . 12.- WILHELM WIEN (1898). Descubrió la relación carga/masa de los protones, tiene el valor de Q/M = 9.58 x 10 4 Coulombs/gramo, a partir del cual calculó que : La masa del protón es = 1.67 x 10 -24 gramos Wilhelm Wien, demostró que los rayos anódicos (flujo de iones positivos) pueden ser desviados por campos magnéticos, y que la cantidad desviada es proporcional a la relación carga/masa. Este descubrimiento conduciría luego a la técnica analítica conocida como espectrometría de masas. Quím Wong - 18 -
- 19. Química I C.B.T.i.s. N° 71 Tantoyuca Ver III.- El descubrimiento de la radiactividad, condujo al descubrimiento del átomo y su divisibilidad. 12.- BEQUEREL, ( 1896), descubrió la radiactividad. Que es la desintegración del átomo en: ü Rayos Alfa, que son partículas con masa de 4 umas y carga de +2 (como nucleos de helio 24He ) que penetran en cuerpos sólidos pero luego pierden sus propiedades. ü Rayos Beta. Es la emisión de partículas de carga eléctrica negativa ( son electrones), que penetran 100 veces más que los rayos alfa. ü Rayos Gamma .- Son ondas electromagnéticas de alta energía, que no tiene masa ni carga.. y son más penetrantes que los alfa y beta. En la desintegración del átomo, cada neutrón se convierte en un protón y un electrón. 13.- James Chadwick (1891-1974) descubrió los neutrones (n ), como las partículas neutras del átomo. Experimentó el comportamiento de los átomos del berilio al ser bombardeados por partículas alfa procedentes del Polonio. Este bombardeo provocaba la emisión de partículas de masa aproximadamente igual a la del protón pero de carga eléctrica nula, ya que no era desviada por los campos eléctricos y por NO tener carga eléctrica, se les llama NEUTRONES. En el experimento de James Chadwick : 1. Empleó polonio que emite radiación alfa, consistente en átomos de helio desprovistos de sus electrones. 2. Los átomos de helio se adentran en un disco de berilio y algunos de ellos chocan con un núcleo de berilio. El choque provoca una reacción que transforma el núcleo de berilio en carbono y desprende un neutrón n . La letra K indica energía cinética: Be9 + He 4 + K = C12+ n1 + K de C12 + K de n1 Descubrimientos relevantes que condujeron al conocimiento del átomo, su divisibilidad y sus partículas; electrones, protones y neutrones: ü El descubrimiento de la electricidad ü El descubrimiento del electromagnetismo ü El descubrimiento de la Radiactividad Quím Wong - 19 -
- 20. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 8.-Competencia: Describe las características de los modelos atómicos en el orden cronológico. MODELOS ATÓMICOS 1.-Modelo atómico de Dalton(1808) . Dalton propuso la 1er Teoría Atómica , que los átomos son pequeñísimas esferas, sólidas de peso fijo, iguales entre sí, diferentes para cada elemento y que se combinan en proporciones definidas de números enteros . 2.- Modelo atómico de Thomson (1897 ). Su modelo de átomos, son esferas que contienen partículas de cargas positivas y cargas negativas, como budines 3.- Modelo atómico de Jean-Baptiste Perrin (1870 1942) Su modelo de átomos. Son esferas con partículas postivas en su interior con las cargas negativas o electrones sobre su superficie. 4.- Modelo atómico de Rutherford (1911). Semejante al sistema solar, con un núcleo pequeñísimo en el centro que condensa casi el 100 % del peso total del átomo y a distancias mucho muy lejanas los electrones moviéndose alrededor de él. NO describe Niveles ni subniveles o espacios energético para los movimientos de los electrones. Descubrió al bombardear los átomos de una lámina delgada con partículas cargadas positivamente, que algunas rebotan en un pequeño núcleo situado en el centro del átomo 5.- Modelo atómico de Bohr .1913 Es un sistema de partículas, formado por un núcleo que encierra protones y neutrones, fuera del cual en 7 posibles órbitas o capas de energía ( n ) muy distantes se mueven y distribuyen los electrones; Encerrados en capas de menor energía 1 ó K hasta la de mayor energía 7 ó K, que son espacios de acomodo según su contenido energético, pero que pueden saltar a niveles superiores, según los cuantos de ener-gía que absorban mismos que se emiten o salen como fotones de energía para que los electrones excitados regresen a sus niveles basales. Actividad.- Describa; estado basal, excitado y estacionario del átomo y los Quím Wong - 20 -
- 21. Química I C.B.T.i.s. N° 71 Tantoyuca Ver Espectros que genera el átomo, de los saltos cuánticos de sus electrones. 6.- Modelo atómico de Sommerfeld (1916). Característica l Es el modelo que asigna el segundo parámetro cuántico: el l ( ele ), el de las formas angulares de los REEMPES. (la Región Espacio Energética de Manifestación más Probable donde se muevan Electrónes, también se llama función de onda o nube electrónica. Son 4 las formas de éstos espacios (REEMPES), para el movimiento de los electrones y cada una tiene su valor energético. Son las siguientes: forma s = 0, forma p = 1, forma d = 2, y la forma f = 3. Éste modelo incluye en los modelos de Bohr y de Sommerfeld y se apoya en la teoría de la relatividad de Einstein, agrega el concepto de subniveles energéticos para especificar, el volumen de movimiento de los electrones. Cuadro que indical: Formas l ( ele ), Nombre, Valor energético y Electrones ( e- ) máximos albergados en cada forma energética Valor Electrones ( e- ) máximos alberenergético gados en cada forma energética Formas angulares l ( ele ) de las REEMPES s esféricas Nombre sharp S=0 2 e- p ovoideas en 2 mancuernas . (dumbbells) principal P=1 6 e- d son ovoides . y anillo en 4 mancuernas difuso d=2 10 e- f complejas . 8 mancuernas fundamental f=3 14 e- . Quím Wong - 21 -
- 22. Química I REEMPES d dxy, C.B.T.i.s. N° 71 dxz, Tantoyuca Ver dyz, dz2, dx2-y2 Cuatro de ellos tienen forma de 4 lóbulos en dos planos nodales, en diferentes orientaciones del espacio, y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales. l = d, valor energético = 2 Quím Wong - 22 -
- 23. Química I C.B.T.i.s. N° 71 Tantoyuca Ver Las REEMPES f, tienen un valor energético = 3 Presentan n-4 nodos radiales. Éstas formas son las 7 siguientes : 1) 2) 3) 4) 5) 6) 7) fz3 fxz2 fyz2 fx(x2-3y2) fy(y2-3x2) fxyz fz(x2-3y2) Un REEMPE es una función de onda, espacial e independiente del tiempo a la ecuación de Schrödinger Cuando se dice que el electrón esta en cierto orbital o reempe, se quiere decir que la distribución de la densidad electrónica o la probabilidad de localizar al electrón en el espacio esta descrita por el cuadrado de la función de onda asociada con ese orbital. Cada reempe u orbital atómico en consecuencia tiene una energía característica y cuantizada. Así por ejemplo, la densidad electrónica en el núcleo atómico es cero ( 2 = 0), significa que no existe ninguna probabilidad que un electrón se encuentre en el núcleo atómico El REEMPE es la descripción ondulatoria del tamaño, forma y orientación de una región del espacio disponible para un electrón. 7.- Modelo atómico de Schrodinger. Es el que describe al tercer parámetro, el número cuántico m , el del campo magnético, el cual limita los espacios permitidos para el movimiento de los electrones .Los valores de m cuya fórmula es: m= -l 0 + l Son los valores que empiezan desde el valor negativo l , los que siguen incluyendo el cero , hasta anotar el valor positivo de + l Quím Wong - 23 -
- 24. Química I C.B.T.i.s. N° 71 Tantoyuca Ver NÚMERO CUÁNTICO m Los valores del número cuántico magnético m, nos da el número de reempes que tiene el subnivel, en función limitada por el magnetismo. Los valores magnéticos m , van desde el valor negativo de l pasando por cero, hasta el valor positivo de l . m = -l 0 +1 s = 0 sharp Recuerde que los valores energéticos del parámetro cuántico l son: l = p = 1 principal El nombre de los orbitales atómicos se debe a sus líneas espectrosd = 2 diffuse cópicas (en inglés s sharp, p principal, d diffuse y f (fundamental) f = 3 fundam. REPRESENTACIÓN DE LOS REEMPES MEDIANTE DIAGRAMAS DE CAJA VALORES DE m para el orbital Sharp (s =0 ) Como el reempe s tiene valor de l = 0 Al aplicar la fórmula de m = -l 0 +1 Substituyendo el valor l tenemos que: m = -0 0 +0 Al no existir el -0 ni el +0, por lo tanto, solamente tenemos un solo valor, el cero: m = 0. Que es un reempe que no se subdivide. m= 0 Diagrama de cajas Reempes para s: . s Uno solo. En cada reempe solamente puede haber dos electrones máximos con movimientos contrarios VALORES DE m para el orbital principal (p =1 ) Para conocer el N° de reempes en los que se subdivide éste orbital, aplicar: m = -l 0 +1 Substituyendo el valor de p = 1, tenemos que si: m = -1, 0, +1 Entonces p se subdivide en tres reempes cuyos valores m son m= -1 , m= 0 y m= +3 Son tres valores magnéticos localizables en el espacio tridimensional de los ejes x, y, z , que se representan mediante diagramas de cajas de la siguiente manera: Valores m= -1 0 +1 magnéticos m 3 reempes p con 2 electrones máximos px = -1 = 3 x 2 = 6 electrones máximos en p py = 0 Reempes px py pz p se subdivide en 3 reempes, pz = +1 VALORES DE m para el orbital diffuse (d =2 ) El reempe d=2, se subdivide en 5 reempes, conocidos con la fórmula m = -l 0 Desde el negativo de 2 hasta el positivo de 2 m = -2, -1, 0, +1, m = -2, d -1, d 0, d +1, d +2 +1 +2 Cada reempe acepta solamente a 2 electrones(e-) máximos, con movimientos opuestos, d = 5 reempes x 2e- máximos = 10e- máximos. d Quím Wong - 24 -
- 25. Química I C.B.T.i.s. N° 71 Tantoyuca Ver VALORES DE m para el orbital fundamental (f =3 ) El reempe f=3, se subdivide en 7 reempes cuyos valores m . Van desde -3 hasta +3 de acuerdo a m = -l 0 +1 m = -3 -2 -1 0 +1 +2 +3 c/reempe acepta máximo 2 e- f f f f f f f entonces en 7f x 2e- = 14 e- máximos f = 14 e- máximos Nota: El Modelo de Dirac-Jordan propuesto en el año 1928. Aporta el conocimiento del Spín ó ms que tiene cada electrón según su giro y puede tener sólo 2 valores: +1/2 ó representado con una flecha hacia arriba . O bien -1/2 ó Características del Modelo Atómico de Schrödinger ü El modelo atómico de Schrödinger predice adecuadamente las líneas de emisión espectrales, tanto de átomos neutros como de átomos ionizados. ü Predice la modificación de los niveles energéticos cuando existe un campo magnético o eléctrico (efecto Zeeman y efecto Stark respectivamente). ü Además, con ciertas modificaciones semiheurísticas el modelo explica el enlace químico y la estabilidad de las moléculas. ü Cuando se necesita una alta precisión en los niveles energéticos puede emplearse un modelo similar al de Schrödinger, pero donde el electrón es descrito mediante la ecuación relativista de Dirac en lugar de mediante la ecuación de Schrödinger. El átomo reside en su propio eje. ü Sin embargo, el nombre de "modelo atómico" de Schrödinger puede llevar a una confusión ya que no explica la estructura completa del átomo. ü El modelo de Schrödinger explica sólo la estructura electrónica del átomo y su interacción con la estructura electrónica de otros átomos, pero no explica como es el núcleo atómico ni su estabilidad. Quím Wong - 25 -
- 26. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 8.- Modelo atómico de Dirac-Jordan. 1928.- Es el modelo atómico que además de los parámetros cuánticos ya mencionados ( n, l, m,) postula el cuarto parámetro cuántico; el del spin ms , Según sea el giro del electrón, tiene dos valores: +1/2 ó o bien -1/2 ó . Aplica los principios de la mecánica cuántica y de la teoría de la relatividad especial y en una ecuación predice las antipartículas. La ecuación de Dirac fue originalmente formulada para describir el electrón, aunque actualmente la ecuación se aplica a otros tipos de partículas elementales de espín ½, como los quarks. Una ecuación modificada de Dirac describe de forma aproximada los protones y los neutrones, estos últimos formados por partículas más pequeñas llamadas quarks, que no son partículas elementales. La ecuación de Dirac se explica mediante matemáticas complejas, de niveles superiores al nivel Bachillerato: Dirac predice, en la teoría de los agujeros, la existencia de electrones cargados positivamente. Que se verificó con el descubrimiento del positrón, en el año 1932, por Carl Anderson. A pesar de este éxito, la teoría fue descartada porque implicaba la creación y destrucción de partículas, enfrentándose así a una de las consecuencias básicas de la relatividad. Esta dificultad fue resuelta mediante su reformulación como una teoría cuántica de campos. Añadir un campo electromagnético cuantificado en esta teoría conduce a la moderna teoría de la electrodinámica cuántica (Quantum Electrodynamics, QED). 2py2 2s2 El protón y el neutrón no son partículas elementales, ya que están compuestos de partículas más pequeñas llamadas quarks. 1s2 MODELO ATÓMICO DE DIRAC-JORDAN 2px2 Eje X . . 2pz2 EJE Z Quím Wong EJE Y - 26 -
- 27. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 9.- Competencia: Enuncia los Principios que fundamentan el modelo cuántico del átomo. Configuración electrónica del átomo.- Es el sistema que indica cómo se distribuyen los electrones en los distintos espacios energéticos en los que se divide el átomo. La configuración electrónica de un átomo se basa en los siguientes 4 principios que fundamentan el modelo atómico de la mecánica Cuántica Ondulatoria: 1.- Principio de la dualidad del electrón, de Louis Victor de Broglie. 1924 Dice que los electrones tienen un comportamiento dual, que se comportan como partículas y a la vez como ondas. Se basa en la ecuación de Einstein, que relaciona masa - energía y en la ecuación de Planck que relaciona la energía de una radiación con su frecuencia. 2.- Principio de exclusión de Wolgang Ernest Pauli (1925) "Dos electrones de un átomo no pueden tener al mismo tiempo los mismos 4 números cuánticos". No pueden existir dos fermiones (electrones) con sus cuatro números cuánticos iguales. 3.- Principio de Máxima Multiplicidad ó regla de Aka Hermann Friedrich Hund. 1925 El llenado con electrones de los reempes de un subnivel se inicia con un electrón spin de +1/2 o en cada uno de todos sus reempes y cuando ya todos tengan uno, se reinicia a partir de su primer reempe con un electrón de spin contrario de -1/2 o . Así se van formando parejas de electrones en cada reempe , pero con spines opuestos. 4.- Principio de Incertidumbre o de indeterminación de Werner K. Heissenberg. 1927 No hay certeza para predecir simultáneamente , la posición y la velocidad del electrón en un momento dado., ya que la energía radiante (fotones) que posibilita las mediciones le perturba movimiento y posición. 5.- Principio de Edificación Progresiva ó Aufbauprinzip, formulado por Niels Bohr. Si los reempes de un subnivel ya se acompletaron de electrones , el siguiente electrón que se acomode (llamado electrón diferencial), lo hace en el primer reempe del siguiente subnivel, que sea de menor energía n+l CONFIGURACIONES ELECTRÓNICAS Quím Wong - 27 -
- 28. Química I C.B.T.i.s. N° 71 Tantoyuca Ver 10.- Competencia: Explica el procedimiento de los dos métodos de notación, mediante ejercicios, para examinar las configuraciones electrónicas de los átomos de los elementos: a) La notación, spdf b) La notación, diagrama de cajas de orbitales ms = +1/2 ó m=-l Los Números cuánticos son: n, l, m y ms 0 y - 1/2 ó +l Diagrama de Moeller Nivel subniveles nl Es= 1 2 n=1 n=2 n=3 n=4 n=5 n=6 n=7 1s 2s 3s 4s 5s 6s 7s 3 4 5 6 7 8 Valores energéticos de los l Momentos angulares 2p 3p 4p 5p 6p 7p 3d 4d 5d 6d s=0 p=1 d=2 f=3 4f 5f El Valor energético de cada subnivel( Es) se conoce sumando los valores de n + l Es = n + l ü Orden progresivo de los subniveles por su valor energético: ORDEN 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 1+0 2+0 2+1 3+0 3+1 4+0 3+2 4+1 5+0 4+2 5+1 6+0 n+ l Es 1 2 3 3 4 4 5 5 5 6 6 6 continuación 4f 5d 6p 7s 5f 6d 7p 4+3 5+2 6+1 7+0 5+3 6+2 7+1 7 7 7 7 8 8 8 Orden progresivo de los 19 subniveles 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s De menor Energía Orden Energético Quím Wong - 28 - 5f 6d 7p De mayor Energía
- 29. Química I C.B.T.i.s. N° 71 Tantoyuca Ver CONFIGURACIONES ELECTRÓNICAS DE LOS ÁTOMOS DE LOS ELEMENTOS Nota: Los Gases nobles: 2He, 10Ne , 18Ar, 36Kr, 54Xe, 86Rn son anotados entre corchetes con su número atómico y su símbolo para simplificar la representación de las configuraciones electrónicas= lo que se conoce como utilización del KERNEL 1s2 2s2 2p6 2 He 3s2 3p6 10 Ne 4s2 3d10 4p6 18Ar 5s2 4d10 5p6 36 Kr Método: Notación spdf 6s2 4f14 5d10 6p6 54Xe 86 Rn Método: Diagrama de cajas de los orbitales y los 4 N° cuánticos N° atómico 1 = HIDRÓGENO 1H = 1s 1 m= 0 Con un electrón 1H = 1s n= 1 N° atómico 2 = HELIO 2He = 1 s2 = 2He l=s ó 0 Dos electrones hace la diferencia 2He = 1 s Sus 4 N° Cuánticos: n= 1 l=s ó 0 m= 0 . electrón acomodado ) 3Li = 2He N° atómico 4 = BERILIO = 2He , 2s m= 0 , 2s2 4Be = 2He - 29 - m=0 ms = +1/2 ó e- diferencial , 2s Sus 4 N° Cuánticos: . n= 2 l =S ó 0 Quím Wong ms = -1/2 ó e- diferencial (el último Sus 4 N° Cuánticos: . n= 2 l =S ó 0 4Be ms = +1/2 ó el último electrón acomodado m= 0 , 2s1 m= 0 e- diferencial m= 0 N° atómico 3 = LITIO 3Li Sus 4 N° Cuánticos son: m= 0 ms = -1/2 ó
- 30. Química I C.B.T.i.s. N° 71 Tantoyuca Ver e- diferencial N° atómico 5 = BORO 5B = 2He m = -1 , 2s2 , 2p1 5B = 2He 0 , 2s2 , 2px Sus 4 N° Cuánticos: n=2 l=1óp +1 2py 2pz m = -1 ms = +1/2 ó . e- diferencial N° atómico 6 = CARBONO m = -1 6C = 2 He , 2s2 , 2p2 6C 2s2 , = 2He , 0 2py 2px Sus 4 N° Cuánticos: n=2 l=1óp +1 2pz m= 0 ms = +1/2 ó . e- diferencial N° atómico 7 = NITRÓGENO 7N = 2He 2 m = -1 3 = 2 He , 2s2, 2px 2py 2pz Sus 4 N° Cuánticos: n=2 l=1óp Principio de Máxima Multiplicidad ó regla de Friedrich Hund 2He m = +1 e- diferencial 0 +1 m = -1 , 2s2 , 2p4 8O = 2He 2s2, Sus 4 N° Cuánticos: n=2 l=1óp Quím Wong ms = +1/2 ó . Si ya todos los reempes del subnivel poseen un electrón con valor del spin de +1/2 ( ó bien ) , hasta entonces los demás electrones empiezan a colocarse con spin de -1/2 ( ó bien ), para formar pares de electrones o apareamientos en los reempes, hasta saturar así, la totalidad del subnivel energético. N° atómico 8 = OXÍGENO = +1 , 2s , 2p 7N 8O 0 - 30 - 2px 2py m = -1 2pz ms = - 1/2 ó .
- 31. Química I C.B.T.i.s. N° 71 Método: Notación spdf Tantoyuca Ver Método: Diagrama de cajas de los orbitales y los 4 N° cuánticos N° Atómico 9 = FLUOR m = -1 9F = , 2s2 , 2p5 2He = 2He 2, 10 Ne 6 , 2s 2p = 10Ne , 2s 2 , 2px 2py 2pz = , 2s2 , 2px, 2py, 2pz 2He Los 4 N° Cuánticos del electrón diferencial: n=2 l=1óp m = +1 ms = - 1/2 ó . e- diferencial m= 0 N° Atómico 11 = SODIO 11Na 2 He e- diferencial +1 Los 4 N° Cuánticos del electrón diferencial: n=2 l=1óp m= 0 ms = - 1/2 ó . e- diferencial m = -1 0 +1 N° Atómico 10 = NEON 10Ne 9F= 0 10 Ne , 3s1 = 10Ne , 3s Los 4 N° Cuánticos del electrón diferencial: n=3 l=0 m=0 ms = +1/2 ó N° Atómico 12 = MAGNESIO 12Mg = 10 Ne m= 0 12 Mg , 3s2 13 Al = 10 Ne , 3s m = -1 1 0 +1 , 3s , 3p 13 Al Nota: Ver llenado de 8O, 9F y 10Ne. Y aplique la regla de Hund para continuar con el 14 Si , 15 P, 16S, 10 Ne Los 4 N° Cuánticos del electrón diferencial: n= 3 l=0 m=0 ms = -1/2 ó e- diferencial N° Atómico 13 = ALUMINIO 2 = e- diferencial 17Cl hasta el = 10 Ne , 3s2, 3px, 3py, 3pz Los 4 N° Cuánticos del electrón diferencial: 18 Ar. n= 3 Quím Wong - 31 - l=1óp m = -1 ms = +1/2 ó
- 32. Química I C.B.T.i.s. N° 71 Tantoyuca Ver N° Atómico 19 = ALUMINIO 19 K = 18Ar m= 0 , 4s1 13 Al = 18 Ar , 4s Los 4 N° Cuánticos del electrón diferencial: n= 4 l=0ós N° Atómico 19 = ALUMINIO 20 K = 18Ar m=0 ms = -1/2 ó m= 0 , 4s2 13 Al = 18 Ar , 4s Los 4 N° Cuánticos del electrón diferencial: n= 4 CONFIGURACIONES ELECTRÓNICAS DE Los de clase d se denominan; elementos de transición , ellos intercambian de posición, dos de sus subniveles (anomalías): Antisarrus (Antiserruchos). N° Atómico 21 = ESCANDIO . . 1s, 2s, 2p, 3s, 3p, 4s, 3d, cambia por 1s, 2s, 2p, 3s, 3p, 3d , 4s 21 Sc = [18Ar], 4s2, 3d1 l=0ós m=0 ms = -1/2 ó ELEMENTOS DE TRANSICIÓN ( A los de clase f se les llama elementos de transición interna ). m = -2 -1 0 +1 +2 21 Sc = [18Ar], 4s2, 3d, 3d, 3d, 3d, 3d, Los 4 N° Cuánticos del electrón diferencial: n= 3 l=dó2 m = -2 ms = +1/2 = m = -2 -1 21 Sc = [18Ar], 3d1, 4s2 0 +1 +2 21 Sc = [18Ar] , 3d, 3d, 3d, 3d, 3d, N° Atómico 22 = TITANIO 22 Ti = [18Ar], 4s2, 3d2 2 4s2 m = -2 -1 0 +1 +2 22 Ti = [18Ar], 4s2, 3d, 3d, 3d, 3d, 3d, 2 22 Ti = [18Ar], 3d , 4s . Los 4 N° Cuánticos del electrón diferencial: n= 3 Trabajo: Continuar las configuraciones del 21 . l=dó2 m = -2 ms = +1/2 = Sc al 30 Zn. Como las anteriores que se te han dado. m = -2 -1 0 +1 +2 Aplicando la regla de Hund 22 Ti = [18Ar] , 3d, 3d, 3d, 3d, 3d, 4s2 Quím Wong - 32 - .
- 33. Química I C.B.T.i.s. N° 71 Tantoyuca Ver m = -2 -1 0 +1 +2 N° Atómico 23 = VANADIO 23 V = [18Ar], 4s2 , 3d, 3d, 3d, 3d, 3d 23 V = [18Ar], 4s 2, 3d3 Los 4 N° Cuánticos del electrón diferencial: n= 3 l=dó2 m=0 ms = +1/2 = . ü LA CONFIGURACIÓN ESPECIAL CORRECTA: 23 m = -2 -1 V = [18Ar], 3d3, 4s2 0 +1 +2 23 V = [18Ar], 3d, 3d, 3d, 3d, 3d, 4s2 N° Atómico 24 = CROMO Cr = [18Ar] , 4s2, 3d4 24 m = -2 -1 0 +1 +2 24 Cr = [18Ar], 4s2 , 3d, 3d, 3d, 3d, 3d LA CONFIGURACIÓN ESPECIAL CORRECTA: ü 24 Los 4 N° Cuánticos del electrón diferencial: Cr = [18 Ar] , 3d5 , 4s1 n= 3 l=dó2 m = +1 m = -2 -1 ms = +1/2 = 0 +1 +2 24 Cr = [18Ar], 3d, 3d, 3d, 3d, 3d, N° Atómico 25 = MANGANESO 25 m = -2 -1 Mn = [18Ar] , 4s2 , 3d5 25 LA CONFIGURACIÓN ESPECIAL CORRECTA: ü 25 Mn = [18Ar] , 3d , 4s 0 +1 +2 Mn = [18Ar] , 4s2 , 3d, 3d, 3d, 3d, 3d n= 3 5 4s 1 l=dó2 m = +2 m = -2 -1 ms = +1/2 = 0 +1 +2 2 Quím Wong 25 Mn = [18Ar], 3d, 3d, 3d, 3d, 3d, 4s2 - 33 -
- 34. Química I C.B.T.i.s. N° 71 Tantoyuca Ver N° Atómico 26 = HIERRO 26 m = -2 -1 Mn = [18Ar] , 4s2 , 3d6 26 LA CONFIGURACIÓN ESPECIAL CORRECTA: ü 26 0 +1 +2 Mn = [18Ar] , 4s2 , 3d, 3d, 3d, 3d, 3d n= 3 Mn = [18Ar] , 3d6 , 4s2 l=dó2 m = -2 m = -2 -1 ms = -1/2 = 0 +1 +2 26 Mn = [18Ar], 3d, 3d, 3d, 3d, 3d, 4s2 ELEM. DE TRANSICIÓN INTERNA ELEM. DE TRANSICIÓN INTERNA Lantánidos (57 a 71) y Actínidos ( 89 a 103) N° Atómico 57 = LANTANO Lantánidos(57 a 71) y Actínidos( 89 a 103) m = -3 -2 -1 0 2 57 La = [54Xe], 6s , 5f +1 +2 +3 1 57 La = [54Xe], 6s2, 5f, 5f, 5f, 5f, 5f, 5f, 5f n= 5 La configuración correcta es: 57 La = [54 Xe] 4f 2 6s2 l=fó3 m = -3 ms = + 1/2 = m = -3 -2 -1 0 +1 +2 +3 57 La = [54Xe], 5f, 5f, 5f, 5f, 5f, 5f, 5f 6s N° Atómico 58 = CERIO m = -3 -2 -1 0 58Ce = [54Xe] 6s2 4f 2 +1 +2 +3 58 Ce = [54Xe], 6s2, 5f, 5f, 5f, 5f, 5f, 5f, 5f n= 5 l=fó3 m = -2 ms = + 1/2 = Configuración correcta: La configuración correcta es: m = -3 -2 -1 0 +1 +2 +3 58Ce = [54Xe] 4f 2 6s2 58 Ce = [54Xe], 5f, 5f, 5f, 5f, 5f, 5f, 5f , 6s Quím Wong - 34 -
- 35. Química I d1 d2 C.B.T.i.s. N° 71 d3 Tantoyuca Ver d4 d5 d6 21 22 ESCANDIO TITANIO 1 2 [18Ar] 3d 4s [Ar] 3d2 4s2 23 VANADIO [Ar] 3d3 4s2 24 CROMO [Ar] 3d5 4s1 39 ITRIO [36Kr] 4d1 5s2 40 CIRCONIO [Kr] 4d2 5s2 41 NIOBIO [Kr] 4d4 5s1 42 MOLIBDENO [Kr] 4d5 5s1 43 TECNECIO [Kr] 4d5 5s2 44 RUTENIO [Kr] 4d7 5s1 57 a 71 Lantánidos 72 HAFNIO 73 TANTALIO 74 VOLFRAMIO 75 RENIO 76 OSMIO . [Xe] 4f 14 5d2 6s2 [Xe] 4f 14 5d3 6s2 d7 25 26 MANGANESO HIERRO [Ar] 3d5 4s2 [Ar] 3d6 4s2 [Xe] 4f14 5d4 6s2 [Xe] 4f 14 5d5 6s2 d8 d9 [Xe] 4f 14 5d6 6s2 d10 27 COBALTO 28 NIQUEL 29 COBRE 30 ZINC [18Ar] 3d7 4s2 [18Ar] 3d8 4s2 [18Ar] 3d10 4s1 [18Ar] 3d10 4s2 45 RODIO 46 PALADIO 47 PLATA 48 CADMIO [36 Kr] 4d8 5s1 [36 Kr] 4d10 [36 Kr] 4d10 5s1 [36 Kr] 4d10 5s2 77 IRIDIO 78 PLATINO 79 ORO 80 MERCURIO [Xe] 4f 14 5d7 6s2 [Xe] 4f14 5d6 6s1 [Xe] 4f 14 5d10 6s1 [Xe] 4f 14 5d10 6s2 Quím Wong - 35 -
- 36. Química I C.B.T.i.s. N° 71 Tantoyuca Ver LANTÁNIDOS CERIO 3,4 58 6,77 1,12 3,4 59 1071 Ce 1,13 5,47 4 5,49 (144,91) 7,2 5 2 [Xe] 4f 6s [54Xe] 4f 2 6s2 [Xe] 4f 3 6s2 [Xe] 4f 6s SAMARIO EUROPIO GADOLINIO 62 7,52 3,2 1,17 1347 3,2 63 5,63 150,36 Eu 151,96 5,24 8,55 3 1685 [Xe] 4f ITERBIO 6,97 11 6s 1,1 1092 Yb 1469 6,254 [Xe] 4f 14 6s2 71 9,84 3 Lu 174,96 3545 6,15 6,02 2 9,07 1629 158,92 3 2 9 [Xe] 4f 6s 3500 5,86 2 TULIO 1,24 1802 3,2 69 3140 167,259 6,101 168,93 1,27 1936 3668 5,43 [Xe] 4f 14 5d1 6s2 - 36 - 9,32 [Xe] 4f 13 6s 1,25 1818 Tm Er [Xe] 4f 12 6s2 Quím Wong 1,1 Tb 8,23 1 68 LUTECIO 3,2 173,04 2968 164,930 5,93 [Xe] 4f 10 6s2 70 2968 Ho 8,80 1585 [Xe] 4f 5d 6s 1,23 5,55 2 3,4 65 ERBIO 3 67 2840 162,500 7 3273 TERBIO 1,20 157,25 2 HOLMIO 1,22 Dy Gd 5,67 [Xe] 4f 6s DISPROSIO 66 1800 7,90 7 [Xe] 4f 6 6s2 3 64 1095 2067 Sm 1,2 1315 Pm 144,24 6,77 3 1,13 61 3347 Nd 5,42 140,90 1,14 1294 3785 3715 140,11 3 60 1204 Pr 6,77 PROMECIO NEODIMIO PRASEODIMIO 2223 6,18 2
- 37. Química I C.B.T.i.s. N° 71 Quím Wong Tantoyuca Ver - 37 -
- 38. Química I C.B.T.i.s. N° 71 Quím Wong Tantoyuca Ver - 38 -
- 39. Química I C.B.T.i.s. N° 71 Quím Wong Tantoyuca Ver - 39 -
- 40. Química I C.B.T.i.s. N° 71 Quím Wong Tantoyuca Ver - 40 -
