Folleto de Nomenclatura Química Nivel 0
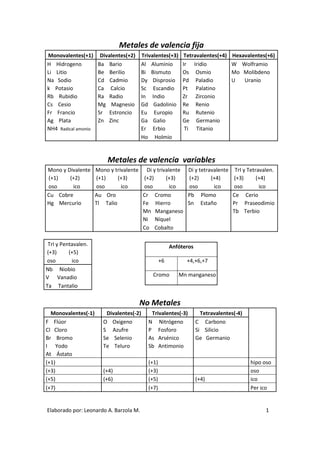
- 1. Metales de valencia fija Monovalentes(+1) Divalentes(+2) Trivalentes(+3) Tetravalentes(+4) Hexavalentes(+6) H Hidrogeno Ba Bario Al Aluminio Ir Iridio W Wolframio Li Litio Be Berilio Bi Bismuto Os Osmio Mo Molibdeno Na Sodio Cd Cadmio Dy Disprosio Pd Paladio U Uranio k Potasio Ca Calcio Sc Escandio Pt Palatino Rb Rubidio Ra Radio In Indio Zr Zirconio Cs Cesio Mg Magnesio Gd Gadolinio Re Renio Fr Francio Sr Estroncio Eu Europio Ru Rutenio Ag Plata Zn Zinc Ga Galio Ge Germanio NH4 Radical amonio Er Erbio Ti Titanio Ho Holmio Metales de valencia variables Mono y Divalente Mono y trivalente Di y trivalente Di y tetravalente TrI y Tetravalen. (+1) (+2) (+1) (+3) (+2) (+3) (+2) (+4) (+3) (+4) oso ico oso ico oso ico oso ico oso ico Cu Cobre Au Oro Cr Cromo Pb Plomo Ce Cerio Hg Mercurio Tl Talio Fe Hierro Sn Estaño Pr Praseodimio Mn Manganeso Tb Terbio Ni Níquel Co Cobalto TrI y Pentavalen. Anfóteros (+3) (+5) oso ico +6 +4,+6,+7 Nb Niobio V Vanadio Cromo Mn manganeso Ta Tantalio No Metales Monovalentes(-1) Divalentes(-2) Trivalentes(-3) Tetravalentes(-4) F Flúor O Oxigeno N Nitrógeno C Carbono Cl Cloro S Azufre P Fosforo Si Silicio Br Bromo Se Selenio As Arsénico Ge Germanio I Yodo Te Teluro Sb Antimonio At Ástato (+1) (+1) hipo oso (+3) (+4) (+3) oso (+5) (+6) (+5) (+4) ico (+7) (+7) Per ico Elaborado por: Leonardo A. Barzola M. 1
- 2. Capítulo 5 Nomenclatura Química y Formulación Antes de comenzar este capítulo, debes saber los números de oxidación de cada elemento químico y reconocer a que familia pertenece dicho elemento. Por ejemplo: El aluminio(Al) su número de oxidación es +3 Y pertenece a los metales de valencia fija trivalentes. (Al+3) FORMULACION DE LOS COMPUESTOS QUIMICOS. Cuando se realiza una función química, se debe escribir primero el catión (+) con su número de oxidación y luego el anión (-) con su respectivo número de oxidación. Por ejemplo: Al+3 + O-2 Para realizar la combinación de estos dos elementos químicos se debe intercambiar sus números de oxidación, es decir el +3 del aluminio pasará al oxígeno; y el -2 del oxígeno pasara al aluminio. ¡Recuerda! aunque el oxigeno u otro elemento sea negativo, estos valores se colocan siempre positivos; aquellos números se denominan subíndices e indica el número de átomos de cada elemento en la molécula formada. Por ejemplo: Al+3 + O-2 = Al2O3 Para este compuesto químico (molécula), hay 2 átomos de Al y 3 átomos de O Compuestos binarios: están constituidos por dos clases de elementos (Ejemplo óxidos básicos) Al2O3; Fe2O3 Compuestos ternario: están constituidos por tres clases de elementos (Ejemplo Hidróxidos) Ba(OH)2; Al(OH)3 Compuestos cuaternario: están constituidos por cuatro clases de elementos (Ejemplo sales básicas) Cu(OH)Cl Elaborado por: Leonardo A. Barzola M. 2
- 3. NOMENCLATURA QUÍMICA La Nomenclatura es un conjunto de nombres técnicos estandarizados que sirven para nombrar e identificar los diferentes compuestos, que surgen al momento de combinar dos o más elementos, como son los óxidos, hidruros, peróxidos, ácidos, etc. Para nombrar un compuesto químico, existen tres nomenclaturas que son: La Clásica o antigua o empírica, la IUPAC o moderna, y la Stock. Si hacemos un pequeño ejemplo sobre esto, es como nuestra identidad, nosotros poseemos dos nombres, en cambio los compuestos químicos poseen tres, en nuestra vida diaria de los dos nombres uno es más usado que el otro ; lo mismo sucede con los compuestos químicos. ESTO ES MUY IMPORTANTE QUE RECUERDES Para los compuestos creados con los metales de valencia fija se deben escribir con la nomenclatura antigua o tradicional. Para los compuestos creados con los metales de valencia variables además de la nomenclatura antigua se lo puede nombrar con la nomenclatura Stock. Para los compuestos creados con los no metales se lo nombra con la nomenclatura sistemática o IUPAC. Nomenclatura Antigua o Tradicional Se utiliza para nombrar funciones hechas con los metales. Para nombrar los compuestos químicos con esta nomenclatura, se escribe el nombre genérico, seguido por la preposición “de” y el nombre específico del elemento Ejemplo: N. Genérico N. Especifico Al2O3 = Oxido de aluminio Cuando el elemento es de valencia variable se omite la palabra “de” y al nombre del elemento se añade la terminación: hipo oso, oso, ico, o per ico, todo esto depende de la valencia que estés trabajando. Ejemplo: El hierro posee dos valencias (valencia variable) que son: +2(oso) y +3(ico) Fe2O3 = Oxido férrico Elaborado por: Leonardo A. Barzola M. 3
- 4. ¡Hey!… notaron que escribí férrico, en vez de escribir hiérrico, esto se debe a que, en la nomenclatura clásica o antigua o empírica, se escribe el nombre de donde proviene dicho elemento; hierro proviene del latín ferrum; aquí te presento una lista, de los elementos que debes conocer y recordar: Cu: Cuprum (Cobre) Au: Aurum (Oro) S: Sulfur (Azufre) Pb: Plumbum (Plomo) Fe: Ferrum (Hierro) Nota: cuando no te dicen la determinación hipo oso, oso, ico, per ico y solo te dicen el nombre del metal, esto significa que el metal está trabajando con la mayor valencia, por ejemplo: Fe2O3 = Oxido de hierro (El Hierro trabaja con: +3) Nomenclatura Sistemática Se utiliza para nombrar funciones hechas con los no metales.; es decir que en toda su estructura molecular está constituido por no metales. Se caracteriza porque describe el número de átomos de cada elemento que interviene utilizando prefijos griegos. Para describir el número de átomos de cada elemento de la molécula, se usa los siguientes prefijos griegos: 1=nomo 2=Di 3=tri 4=tetra 5=penta 6=hexa 7=hepta 8=octa 9=nona 10=deca Ejemplo: # Átomos CO2 = Dióxido de carbono N2O3= Trióxido de Dinitogeno Esta correcto escribir: CO2 = Dióxido de monocarbono, pero cuando se trata de la unidad para describir el segundo elemento, la palabra mono se la omite ¡recuérdalo! Elaborado por: Leonardo A. Barzola M. 4
- 5. Nomenclatura STOCK Describe a los compuestos que se realizan con los elementos metálicos de valencia variables. En el sistema Stock se escribe el nombre genérico, seguido por la preposición “de” y el nombre Especifico del elemento, adicionalmente se escribe el número de oxidación del elemento que interviene en números romanos. Ejemplo: Nombre genérico N. Especifico # de oxidación del elemento Cl2O3 = Oxido de Cloro (III) Principales funciones químicas inorgánicas. Función Óxidos Básicos Función Anhídridos formación Metal+ + Oxigeno-2 formación No Metal+ + Oxigeno-2 Formula: Fe2O3 Formula: SO2 Antigua Oxido férrico- oxido de hierro Antigua Anhídrido sulfuroso Stock Oxido de hierro (III) IUPAC Dióxido de azufre Función Ácidos Hidrácidos Función Peróxidos +1 era da formación H + No metal 1 -2 Familia formación Oxido Básico 1era -2da flia. + O Formula: HCl Formula: BaO2 Antigua Acido clorhídrico Antigua Peróxido de bario IUPAC Cloruro de hidrogeno Elaborado por: Leonardo A. Barzola M. 5
- 6. Función Hidróxidos Función Hidruros Metálicos formación Metal+ + OH-1 formación Metal+ + H-1 Formula: Pb(OH)2 Formula: FeH3 Antigua Hidróxido plumboso Antigua Hidruro férrico Hidruro de hierro Stock Hidróxido de plomo (II) Stock Hidruro de hierro (III) Función Ácidos Oxácidos formación Anhídrido + agua(H2O) Formula: HNO3 Antigua Acido nítrico - Nitrato de hidrogeno Stock Acido trioxonitrico (V) Los no metales de la tercera familia (-3) al formar un anhídrido, tienen la capacidad de formar ácidos oxácidos mezclándose con 1, 2, y hasta 3 moléculas de agua, para poder nosotros diferenciar cuantas moléculas se han mezclado, se utiliza los prefijos: META cuando solo se han mezclado 1 molécula H2O PIRO cuando solo se han mezclado 2 moléculas H2O ORTHO cuando solo se han mezclado moléculas 3 H2O ¡Recuerda! Cuando no te dicen el prefijo, se asume que es el mayor de todos, es decir, debes trabajar con ortho. Elaborado por: Leonardo A. Barzola M. 6
- 7. Familia H2O Sufijos Código I hipo oso 111 Br oso 112 I Cl 1 molécula ico 113 N per ico 114 S Se oso 213 II Te 1 molécula ico 214 hipo oso 111 1 oso 112 P molec(META) ico 113 per ico 114 hipo oso 423 As 2 oso 425 III molec(PIRO) ico 427 per ico 429 Sb hipo oso 312 3 oso 313 molec(ORTHO) ico 314 per ico 315 C Si 1 molécula Ico 213 IV Ge otho ico 414 META oso 112 B PIRO oso 425 ORTHO oso 313 La formula de los ácidos oxácidos poseen una estructura de la forma HaXbOc donde X es el elemento que interviene y a,b,c representa el código de la formula. Ejemplos: Acido sulfúrico: H2S1O4 Acido piro fosfórico: H4P2O7 Acido fosfórico o acido ortho fosfórico: H3P1O4 Acido clórico: H1Cl1O3 Elaborado por: Leonardo A. Barzola M. 7
- 8. Nota: en el cuadro anterior se coloco el N en la primera familia, debido a que posee el mismo comportamiento; tengamos presente que el N no pertenece aquella familia. RADICALES En esta unidad estudiaremos dos tipos de radicales; los radicales oxácidos y los radicales hidrácidos. Radicales Oxácidos (RO) Se produce cuando un acido oxácido pierde los átomos del hidrogeno que lo conforma, produciéndose un ion poliatónico donde el valor de la carga será el numero de H desprendidos. Si en el acido oxácido su terminación era oso al transformarse en radical será reemplazado por ito y se omite la palabra acido. Si en el acido oxácido su terminación era ico al transformarse en radical será reemplazado por ato y se omite la palabra acido. Ejemplos: Acido sulfúrico: H2SO4 sulfato: (SO4)-2 Acido cloroso: HClO2 clorito: (ClO2)-1 Radicales Hidrácidos (RH) Se produce cuando un acido Hidrácido pierde los átomos del hidrogeno que lo conforma, produciéndose un ion monoatómico donde el valor de la carga será el numero de H desprendidos. Podemos identificar a los radicales hidrácidos por su terminación en uro Ejemplos: Acido sulfhídrico: H2S sulfuro: (S)-2 Acido clorhídrico: HCl cloruro: (Cl)-1 Elaborado por: Leonardo A. Barzola M. 8
- 9. Función Sales Neutras Función Sales Acidas formación Metal(+) + Radical(-) formación Metal(+) + Radical(-) + H(+1) Formula: MnCl2 Formula: BaHPO4 Antigua Cloruro manganoso Antigua Fosfato acido de bario - Bi fosfato de bario Stock Cloruro de manganeso (II) Stock Hidrogeno tetroxofosfato(V) de bario (II) Función Sales Básicas Función Sales Dobles formación Metal(+) + Radical(-) + HO(-1) formación Metal(+) + Metal(+) + Radical(-) Formula: Cu(OH)Cl Formula: AuPbBr7 Antigua Cloruro básico de cobre Antigua Bromuro de oro y plomo Sub cloruro de cobre Stock Cloruro básico de cobre (II) Stock Bromuro de oro(III) y plomo (IV) Función Sales Mixtas formación Metal(+) + Radical(-)+ Radical(-) Formula: Ag3SO4NO3 Antigua Sulfato nitrato de plata Elaborado por: Leonardo A. Barzola M. 9
- 10. IONES poliatómicos mas importantes. Acetato: CH3COO- o C2H3O2- Permanganato: MnO4- Tiosulfato: S2O32- Oxalato: C2O42- Cromato: CrO42- Dicromato: Cr2O72- Como formular compuestos ternarios y cuaternarios Sal oxisal acida. Para formular una sal oxisal acida primero debemos crear un radical acido, el radical acido proviene de un ácido oxácido al cual le vamos dejar solo con un hidrogeno en la molécula, y el número de hidrógenos desprendidos será la carga negativa: Ejemplos: Bicarbonato de aluminio o Carbonato acido de aluminio 1.-Primero formulemos el ion ácido Acido carbónico = H2CO3 le desprendemos 1 hidrógenos y nos queda: (HCO3)-1 esta molécula se llama bicarbonato. Bi significa H y carbonato = CO3 2.-Lo combinamos con el metal o catión. Al+3 + (HCO3)-1 = Al(HCO3)3 Si sumamos los números de oxidación de cada elemento, podemos confirmar que el resultado de esta suma es 0 por lo cual la formula es correcta. Fosfito ácido de níquel o Bifosfito de níquel 1.-Primero formulemos el ion ácido Acido fosforoso= H3PO3 le desprendemos 2 hidrógenos y nos queda: (HPO3)-2 esta molécula se llama bifosfito. Bi significa H y fosfito= PO3 2.-Lo combinamos con el metal o catión. Ni+3 + (HPO3)-2 = Ni2(HPO3)3 Si le piden formular un compuesto en el cual la nomenclatura sea Fosfito diácido de niquel. Deben solo de fijarse del prefijo que acompaña a la palabra acido, en este caso es di, esto significa que se debe dejar 2 hidrógenos en el radical acido. Elaborado por: Leonardo A. Barzola M. 10
- 11. Ejemplo: 1.-Primero formulemos el ion ácido Acido fosforoso= H3PO3 le desprendemos 1 hidrógenos y nos queda: (H2PO3)-1 esta molécula se llama fosfito Diácido. Diácido significa H2 y fosfito= PO3 2.-Lo combinamos con el metal o catión. Ni+3 + (H2PO3)-1 = Ni(H3PO3)3 BIBLIOGRAFIA: “Química integral 2” Autor: Julio Barzola Montece (Ediciones Holguín) http://es.wikipedia.org/wiki/Qu%C3%ADmica http://plinios.tripod.com/definiciones.htm Elaborado por: Leonardo A. Barzola M. 11
