Introdução à Corrosão - Autor desconhecido
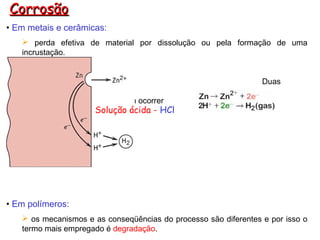
- 1. Corrosão • Em metais e cerâmicas: perda efetiva de material por dissolução ou pela formação de uma incrustação. Duas reações químicas precisam ocorrer Solução ácida - HCl • Em polímeros: os mecanismos e as conseqüências do processo são diferentes e por isso o termo mais empregado é degradação.
- 3. Por que se preocupar com a corrosão? • 3 razões: Custo; Segurança; Conservação de recursos. • Em relação aos custos: Nos E.U.A. a corrosão gera por ano custos da ordem de 4,5% do PIB daquele país; Deste total, cerca de 100 bilhões de dólares são gastos na utilização de materiais mais resistentes à corrosão e no emprego de novas tecnologias; O setor que mais investe no problema é o da indústria automotiva.
- 4. Por que se preocupar com a corrosão? • Em relação à segurança: Muitos componentes e estruturas podem estar suscetíveis a falhar por conseqüência de um processo de corrosão: caldeiras, submarinos, aeronaves, vasos de pressão, hélices de turbinas, pontes, etc. Acidente da Aloha Airlines, em 1998, onde um membro da tripulação morreu e vários passageiros ficaram feridos.
- 5. Por que se preocupar com a corrosão? • Em relação à conservação dos recursos: As reservas de metais e a quantidade de energia disponível em nosso planeta são limitadas. A corrosão pode ser interpretada como o avesso de um processo metalúrgico e muita energia é gasta em um processo de corrosão.
- 6. Potenciais de eletrodo • Nem todos os metais oxidam para formar íons com o mesmo grau de facilidade. A determinação da força motriz para a reação eletroquímica de oxi-redução pode identificar os mais suscetíveis, comparativamente. Pilha eletroquímica que consiste em eletrodos de ferro e de cobre, cada um imerso em uma solução 1M do seu íon. O Fe é corroído, enquanto o Cu se eletrodeposita.
- 7. Lembre-se sempre • Quem perde elétrons sofre oxidação: • Quem ganha elétrons sofre redução: • Eletrólito: solução capaz de conduzir corrente elétrica pelo movimento de íons positivos ou negativos: Ânions : íons negativos Cátions : íons positivos • Anodo: Eletrodo cujos átomos perdem elétrons para o circuito externo, tornando-se íons + e oxidando; • Catodo: Eletrodo que recebe os íons do circuito externo e reduzindo.
- 8. Série de potenciais de eletrodo padrão • Quando a medida da força motriz é feita utilizando-se uma pilha de referência, temos o que se chama de série de potenciais de eletrodo padrão. Com essa série fica mais conveniente comparar as tendências à corrosão dos metais, uns em relação aos outros. O potencial global par a pilha é dado por: ΔVº = Vº2 – Vº1 Para que a reação ocorra espontaneamente ΔVº > 0
- 9. Influência da temperatura e da concentração sobre o potencial de eletrodo • A alteração da temperatura ou da concentração da solução alterará o potencial da pilha e até mesmo reverter a direção da reação espontânea. ΔV = (Vº2 – Vº1) – (RT/nF )ln [M1n+] /[M2n+]) • Para 25ºC: ΔV = (Vº2 – Vº1) – (0,0592/n) log [M1n+] /[M2n+]
- 10. Requisitos para haver corrosão: • A presença de um anodo ou de sítios anódicos na superfície do metal; • A presença de um catodo ou de sítios catódicos na superfície do metal; • Eletrólito em contato com o anodo e com o catodo, formando um caminho para a condução de íons; • Uma conexão elétrica entre o anodo e o catodo, fazendo com que os elétrons sejam fluam entre o anodo e o catodo.
- 11. Taxas de corrosão • A taxa de corrosão de um material pode ser expresso como a Taxa de Penetração da Corrosão (TPC) e calculada pela fórmula: TPC = KW/ρAt W = perda de peso após um tempo t ρ = densidade da amostra A = área da amostra que está exposta K = cte. • Pode-se expressar a taxa de corrosão em termos da corrente elétrica associada com as reações de corrosão eletroquímicas : densidade de corrente. R = i/nF n = nº de elétrons associados à ionização de cada átomo metálico i = corrente F = constante de Faraday, 96.500 C/mol
- 12. Estimativa de taxas de corrosão - Polarização Considere a pilha eletroquímica mostrada na figura abaixo. O sistema está fora de equilíbrio e os valores dos potenciais dos eletrodos não constam da tabela de referência; O deslocamento de cada potencial de eletrodo do seu valor em condições de equilíbrio é chamado de polarização. A magnitude desse deslocamento é a sobrevoltagem (η). A relação entre a sobrevoltagem e a densidade de corrente é dada por: ηa = ± ß log i /i0 ß e i0 representam constantes para a semipilha específica.
- 13. Polarização por ativação Condição em que a taxa de reação é controlada pela etapa da reação eletroquímica que se processa a uma taxa mais lenta. Esquema de possíveis etapas na Gráfico de sobrevoltagem da reação de redução do hidrogênio, cuja polarização por ativação para um taxa é controlada pela polarização por eletrodo de hidrogênio, em função do ativação. logaritmo da densidade de corrente, para as reações de oxidação e redução
- 14. Polarização por concentração Condição em que a taxa de reação é controlada pela difusão no interior da solução. Distribuição dos íons de H+ na Distribuição dos íons de H+ na vizinhança do catodo para baixas vizinhança do catodo para altas taxas de reação e/ou altas taxas de reação e/ou baixas concentrações. concentrações Zona de escassez polarização por concentração
- 15. Polarização por concentração A relação entre a sobrevoltagem de polarização por concentração (ηc) e a densidade de corrente (i) é dada por: ηc = (2,3RT/nF) log(1-i/iL) Gráficos esquemáticos da sobrevoltagem em função do log de i para (a) uma polarização por concentração e (b) uma polarização combinada por ativação e concentração.
- 16. Passividade • Fenômeno observado em alguns metais que perdem sua reatividade química sob determinadas condições específicas, tornando-se inertes. • Materiais de engenharia que são resistentes à corrosão desenvolvem naturalmente um filme fino de óxido, aderente à sua superfície, chamado de película passiva. • Filme de óxido bem fino (da ordem de nm), que age como uma barreira entre o metal e o eletrólito; • Pode ser destruído mas se regenera rapidamente; • Um material passivado pode se converter a um estado ativo se alguma alteração na natureza do ambiente se fizer. Exemplos: Ligas de Al, ligas de Ni e aços inoxidáveis
- 17. Passividade em aços inoxidáveis • Na maioria das vezes o ferro não é resistente à corrosão. • Adicionando-se uma quantidade maior que 12% de Cr em aços pode torná-los altamente resistentes à corrosão devido à formação da película passivadora de óxido de Cr. Os aços 304 SS têm cerca de 18%Cr e 8%Ni, também conhecidos como aços 18-8. Adicionando-se cerca de 2%Mo (316 SS) nessa mistura, a resistência à corrosão destes aços é ainda mais aumentada.
- 18. Formas de corrosão • A corrosão pode ser classificada pelo modo como ela se manifesta. • Em metais ela pode assumir uma das seguintes designações: uniforme; galvânica; em frestas; por pites; intergranular; por lixívia seletiva; erosão-corrosão corrosão sob tensão.
- 19. Corrosão uniforme • As reações de oxidação e redução ocorrem uniformemente sobre toda a superfície do metal, ou uma grande fração desta superfície; • É a forma mais comum de corrosão e também a que mais prejuízo causa em termos toneladas de metal perdidas.
