Termoquímica Exercícios
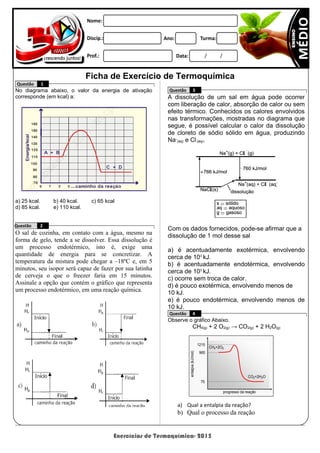
- 1. Exercícios de Termoquímica- 2015 1215 965 75 entalpia(kJ/mol) progresso da reação CH4+2O2 CO2+2H2O Ficha de Exercício de Termoquímica Questão 1 No diagrama abaixo, o valor da energia de ativação corresponde (em kcal) a: a) 25 kcal. b) 40 kcal. c) 65 kcal d) 85 kcal. e) 110 kcal. Questão 2 O sal de cozinha, em contato com a água, mesmo na forma de gelo, tende a se dissolver. Essa dissolução é um processo endotérmico, isto é, exige uma quantidade de energia para se concretizar. A temperatura da mistura pode chegar a –18ºC e, em 5 minutos, seu isopor será capaz de fazer por sua latinha de cerveja o que o freezer faria em 15 minutos. Assinale a opção que contém o gráfico que representa um processo endotérmico, em uma reação química. Questão 3 A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+ (aq) e Cl- (aq). Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal a) é acentuadamente exotérmica, envolvendo cerca de 103 kJ. b) é acentuadamente endotérmica, envolvendo cerca de 103 kJ. c) ocorre sem troca de calor. d) é pouco exotérmica, envolvendo menos de 10 kJ. e) é pouco endotérmica, envolvendo menos de 10 kJ. Questão 4 Observe o gráfico Abaixo. CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) a) Qual a entalpia da reação? b) Qual o processo da reação
- 2. Exercícios de Termoquímica- 2015 Questão 5 (ACR-2004) Com base no gráfico abaixo, julgue as afirmações relativas à reação A + B C + D: 0 0 A reação A + B C + D é exotérmica, pois a entalpia dos produtos é maior que a dos reagentes. 1 1 A variação de entalpia da reação é + 10 kcal. 2 2 Possui energia de ativação de 20 kcal. 3 3 A entalpia dos produtos é de 10 kcal. 4 4 Apresenta variação de entalpia de – 20 kcal. Questão 6 Calcule a energia liberada na combustão de um grama de metano e na combustão de um grama de etanol. Com base nesses valores, qual dos combustíveis e mais vantajoso sob o ponto de vista energético? Justifique. Dados: Massa molar(g/mol): CH4=16; C2H6O=46. Composto Massa molar ∆H (kj/mol) Metano (CH4) 16 g/mol -890 Etanol (C2H5OH) 46 g/mol -1367 Questão 7 Um dos problemas dos combustíveis que contem carbono e que sua queima produz dióxido de carbono. Portanto, uma característica importante, ao se escolher um combustível, e analisar seu calor de combustão (ΔHC0 ), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. O quadro seguinte relaciona algumas substancias que contem carbono e seu ΔHC0 . Neste contexto, qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida? a) Benzeno. b) Metano. c) Glicose. d) Octano. e) Etanol. Questão 8 O acetileno é um gás de grande uso comercial, sobretudo em maçaricos de oficinas de lanternagem. Assinale a opção correspondente à quantidade de calor fornecida pela combustão completa de 5,2 kg de acetileno (C2H2), a 25°C, sabendo-se que as entalpias de formação, a 25°C, são: CO2(g) = – 94,1 kcal/mol; H2O() = – 68,3 kcal/mol; C2H2(g) = + 54,2 kcal/mol) a) 1615 kcal. b) 6214 kcal. c) 21660 kcal. d) 40460 kcal. e) 62140 kcal. Questão 9 No que tange à tecnologia de combustíveis alternativos, muitos especialistas em energia acreditam que os álcoois vão crescer em importância em um futuro próximo. Realmente, álcoois como metanol e etanol têm encontrado alguns nichos para uso doméstico como combustíveis há muitas décadas e, recentemente, vêm obtendo uma aceitação cada vez maior como aditivos, ou mesmo como substitutos para gasolina em veículos. Algumas das propriedades físicas desses combustíveis são mostradas no quadro seguinte. Dados: Massas molares em g/mol: H = 1,0; C = 12,0; O = 16,0. Considere que, em pequenos volumes, o custo de produção de ambos os álcoois seja o mesmo. Dessa forma, do ponto de vista econômico, é mais vantajoso utilizar a) metanol, pois sua combustão completa fornece aproximadamente 22,7 kJ de energia por litro de combustível queimado. b) etanol, pois sua combustão completa fornece aproximadamente 29,7 kJ de energia por litro de combustível queimado. c) metanol, pois sua combustão completa fornece aproximadamente 17,9 MJ de energia por litro de combustível queimado. d) etanol, pois sua combustão completa fornece aproximadamente 23,5 MJ de energia por litro de combustível queimado. e) etanol, pois sua combustão completa fornece aproximadamente 33,7 MJ de energia por litro de combustível queimado.
- 3. Exercícios de Termoquímica- 2015 Questão 10 Considere as supostas variações de entropia (ΔS) nos processos abaixo: I. cristalização do sal comum (ΔS > 0) II. sublimação da naftalina (naftaleno) (ΔS > 0) III. mistura de água e álcool (ΔS < 0) IV. ferro (s) fusão → ferro (l) (ΔS > 0) V. ar compressão → ar comprimido (ΔS < 0) As variações de entropia indicadas nos processos que estão corretas são: a) I, III e IV. b) III, IV e V. c) II, III e V. d) I, II e IV. e) II, IV e V. Questão 11 O estudo das reações químicas que ocorrem com absorção da radiação solar de alta energia e dos processos químicos industriais que causam dano ao meio ambiente faz parte da química ambiental. Alguns exemplos destes tipos de reações são mostrados a seguir. Assinale dentre as alternativas abaixo aquela na qual não se observa um aumento da entropia. a) Calcinação de calcário: CaCO3(s) → CO2(g) CaO(s) b) Fotodissociação de oxigênio: O2(g) → 2O(g) c) Fotodissociação de Freon-12: CF2Cl2(g) → CF2Cl(g) + Cl(g) d) Obtenção de Ferro a partir de seu minério: 2Fe2O3(s) → 4Fe(s) + 3O2(g) e) Formação de ozônio na atmosfera: O2(g) + O(g) → O3(g) Questão 12 Calcule a variação de entropia (ΔS) da reação H2(g) + I2(g) → 2HI(g) a 25ºC, sabendo que, nessa temperatura, as entropias padrão são: H2(g) = 31,2cal/K x mol; I2(g) = 27,9cal/K x mol; HI(g) = 49,3cal/K x mol. Questão 13 Sabendo se que na reação C(grafite) + 2 H2(g) →CH4(g) ΔH < 0 e ΔS < 0 Podemos afirmar que essa reação: a) é espontânea, no caso de |ΔH| <|T⋅ΔS|. b) é espontânea a qualquer temperatura. c) é espontânea, no caso de |ΔH| > |T⋅ΔS|. d) é não espontânea em qualquer temperatura. e) está em equilíbrio em qualquer temperatura Questão 14 (FEI-SP) Para uma reação, sabe-se que ΔH = 20kcal/mol e ΔS = 80cal/mol x K. Qual o ΔG dessa reação a 1000K Questão 15 A variação de entropia de processos físicos e químicos é importante para a espontaneidade dos mesmos. Os processos abaixo apresentam variação positiva de entropia: 0-0) cristalização de um sólido a partir da solução 1-1) evaporação do metanol 2-2) precipitação de AgCl a partir de uma solução aquosa de AgNO3 e NaCl 3-3) CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g) 4-4) fusão do sódio metálico Questão 16 Determinaraespontaneidadedareação:C2H2+2H2 → C2H6 a temperatura de 100ºC. Dados: Questão 17 A equação química abaixo representa a formação do carbeto de cálcio em fornos elétricos: Ca0(s) + 3C(s) → CaC2(s) + CO(g) Utilizando-se os dados abaixo, é possível afirmar que a reação de obtenção do carbeto de cálcio ocorre a uma temperatura (admita que o e o não variam com a temperatura) ∆H ∆S a) abaixo de 1.500ºC. b) entre 500ºC e 1.700ºC. c) acima de 1.947ºC. d) abaixo de 2.220ºC. e) exclusivamente a 3.200ºC. Questão 18 (OSEC) Considerando se a transformação isotérmica N2O(g) → N2(g) + O2(g) a 25°C e sabendo se que a variação de entalpia (ΔH) é 19,5 kcal/mol e que a variação de entropia (ΔS) é 18 cal/grau. mol, podemos afirmar que a variação de energia livre (G) do sistema é: a) +38,50 kcal e espontâneo b) +19,25 kcal e espontâneo c) 19,25kcal e não espontâneo d) +24,86 kcal e não espontâneo e) 24,86 kcal e espontâneo
- 4. Exercícios de Termoquímica- 2015 Questão 19 Calcule o ΔS da reação: PCl → PCl3 + Cl2, a 27ºC,sendo dados o valor do ΔH=22kCal/mol e ΔG = 9 Kcal/mol.
