Destilacion
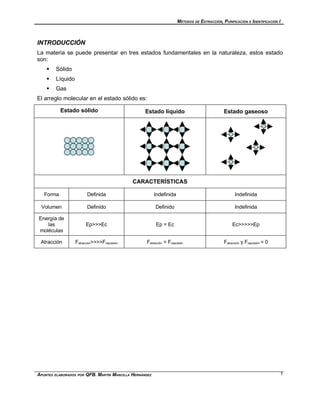
- 1. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I INTRODUCCIÓN La materia se puede presentar en tres estados fundamentales en la naturaleza, estos estado son: Sólido Líquido Gas El arreglo molecular en el estado sólido es: Estado sólido Estado líquido Estado gaseoso CARACTERÍSTICAS Forma Definida Indefinida Indefinida Volumen Definido Definido Indefinida Energía de las Ep>>>Ec Ep = Ec Ec>>>>>Ep moléculas Atracción Fatracción>>>>Frepulsión Fatracción = Frepulsión Fatracción y Frepulsión = 0 1 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ
- 2. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I CAMBIOS DE ESTADO Considerando la teoría cinético molecular, el aumento o disminución de la temperatura en el mayor de los casos, los estados de agregación de la materia, los cuales se representan a continuación: PRESIÓN DE VAPOR La presión de vapor o más comúnmente presión de saturación es la presión a la que a cada temperatura la fase líquida y vapor se encuentran en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. En la situación de equilibrio, las fases reciben la denominación de líquido saturado y vapor saturado. Esta propiedad posee una relación inversamente proporcional con las Fuerzas de Atracción Intermoleculares, debido a que cuanto mayor sea el módulo de las mismas, mayor deberá ser la cantidad de energía entregada (ya sea en forma de calor u otra manifestación) para vencerlas y producir el cambio de estado. Gráfica De la presión de vapor de agua 2 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ
- 3. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I PUNTO TRIPLE DEL AGUA El punto triple es aquel en el cual coexisten en equilibrio el estado sólido, el estado líquido y el estado gaseoso de una sustancia. Se define con una temperatura y una presión de vapor. El punto triple del agua, por ejemplo, está a 273,16 K (0,01°C) y a una presión de 611,73 Pa Esta temperatura, debido a que es un valor constante, sirve para calibrar las escalas Kelvin y Celsius de los termómetros de mayor precisión. Punto triple del agua EFECTO DE LA TEMPERATURA SOBRE LA PRESIÓN DE VAPOR Todos los líquidos tienen una cierta presión de vapor que depende de la temperatura como puede observarse en la siguiente tabla, la cual nos muestra la variación de la presión de vapor con la temperatura. Presión de vapor TºC TºF mm Hg Kg/cm2 0 4.58 0.0062 32 5 6.51 0.0088 41 10 8.94 0.0121 50 15 12.67 0.1072 59 20 17.50 0.0238 68 30 31.62 0.0432 86 40 55.10 0.0749 104 50 92.51 0.1257 122 60 149.38 0.2026 140 70 233.70 0.3176 158 80 355.10 0.4828 176 90 525.80 0.7146 194 100 760.0 1.033 212 3 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ
- 4. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I Presión de vapor TºC TºF mm Hg Kg/cm2 0 4.58 0.0062 32 120 1490 2.026 248 140 2710 3.685 284 160 4630 6.296 320 180 7510 10.213 356 200 11650 15.844 392 Ejercicio: realice la gráfica te temperatura vs presión y describa el comportamiento del gráfico. DESTILACIÓN La destilación es la operación de separar, comúnmente mediante calor, los diferentes componentes líquidos de una mezcla, aprovechando las diferencias de volatilidades de los compuestos a separar. La destilación se da en forma natural de bajo del punto de ebullición (100 grados centígrados en el caso del agua), luego se vuelve nubes y finalmente llueve. Aunque también de forma acelerada hirviendo la sustancia cuando se alcanza el punto de ebullición en una cocina o en un laboratorio. El calentamiento global hace que el agua de los océanos se evapore mas rápido por esto en los últimos años ha llovido tanto, es provocado por el CO 2, el cual impide que el calor salga de la tierra, lo cual provoca un aumento constante del calor en la tierra, en este caso el vapor de agua puede arrastrar ciertas sustancias contaminantes causantes de la lluvia ácida. La destilación se clasifica en: A vacío Simple Fraccionada Bajo reflujo Por arrastre con vapor de agua FUNDAMENTO DE LA DESTILACIÓN De acuerdo con la ley de Raoult, en el caso de que los líquidos sean solubles mutuamente, la presión de vapor de cada uno de ellos es disminuida debido a la presencia del otro. Algunas veces la composición del vapor puede calcularse conociendo la presión de cada uno de los líquidos. Esto se puede hacer cuando en la disolución de dos líquidos no se efectúen reacciones químicas y las moléculas de ambos líquidos sean más o menos del mismo tamaño. Podemos concluir entonces que, un mol de cualquier soluto no volátil abatirá la presión de vapor del disolvente líquido en una cantidad característica para ese disolvente. Debido a la presencia del soluto es necesario hacer una corrección de la presión de vapor del líquido puro para calcular la presión de vapor de la disolución utilizando la siguiente expresión: Presión de vapor = Presión de vapor x Fracción molar (disolución) (disolvente) (disolvente) Que es la expresión de la Ley de Raoult 4 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ
- 5. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I Esta ley sólo es válida para una disolución ideal, es decir que los componentes se mezclen sin una combinación química ni efectos de asociación molecular. La tendencia al escape de un componente depende del porcentaje que dicho líquido ocupe en la disolución, es decir, de la fracción molar y de la presión de vapor. Si Pc es la presión de vapor del componente en el estado puro y a una temperatura dada y “X”, su fracción molar en el líquido, tenemos: Pp = Pc (X) (1) Pp = presión parcial de vapor del líquido X = fracción molar La fracción molar de una sustancia se define como: Fracción molar de una Número de moles de A sustancia A en una mezcla = (2) de sustancias Número total de moles de todas las sustancias La presión total del sistema será: Ptotal = PA XA + PB XB (3) Donde: nA nB XA = XB = nt nt La suma de las fracciones molares para una mezcla es igual a uno nt = nA + nB = 1 Por ejemplo: se desea separar por destilación una mezcla formada por dos moles de benceno y dos moles de tolueno. A 26ºC, la presión parcial del benceno es de 54 mmHg y la del tolueno es de 28 mmHg. ¿Cuál es la presión de vapor de la mezcla resultante? La fórmula a utilizar es la siguiente: Ptotal = Pa Xa + Pb Xb Calculemos el número de moles totales: Para el benceno: nA 2 moles nA = = = 0.5 nt 4 moles 5 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ
- 6. MÉTODOS DE EXTRACCIÓN, PURIFICACIÓN E IDENTIFICACIÓN I Para el tolueno: NB 2 moles nB = = = 0.5 nt 4 moles Apliquemos la fórmula de presión parcial para cada componente (1) Para el benceno: Pp = (0.5)(94 mmHg) = 47 mmHg Para el tolueno: Pp = (0.5)(28 mmHg) = 14 mmHg Por lo tanto aplicando la ecuación (3) tenemos que la presión total es: Ptotal = 47 mm Hg + 14 mm Hg = 61 mmHg Como podrás observar en este proceso de separación, la fracción molar de los componentes es igual a 0.5, por lo tanto, el número de moléculas de benceno es igual al del tolueno; sin embargo, el vapor del sistema tendrá una mayor proporción del componente cuya presión de vapor es más alta, que aquel cuya presión es más baja. En la práctica lo anterior es muy importante, ya que de lo contrario no se podría llevar a cabo la separación mediante la destilación simple. MEZCLA DE LÍQUIDOS Y SÓLIDOS Cuando uno de los componentes de la mezcla es sólido no volátil, P B es igual a cero y la presión total del sistema está dada por PA solamente, esto indica que solo uno de los componentes destilará. MATERIALES UTILIZADOS EN LA DESTILACIÓN Refrigerante: Liebig o recto. El más utilizado Allihn o bola. Se conoce como refrigerante de rosario y se utiliza para reflujo y destilación cuando se necesitan superficies de contacto grandes. Graham o de serpentín. Es el de mayor superficie, se usa en todos los tipos de destilación, sobre todo con grandes volúmenes de líquidos muy volátiles. TIPOS DE DESTILADO Al destilarse una mezcla, se obtienen tres fracciones: Cabeza. Está enriquecida con el componente más volátil Corazón. Componente a separar Cola. Enriquecida con el componente menos volátil 6 APUNTES ELABORADOS POR QFB. MARTÍN MANCILLA HERNÁNDEZ