გაკვეთილი № 13
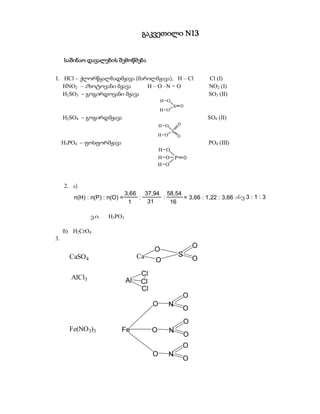
- 1. გაკვეთილი 13 საშინაო დავალების შემოწმება 1. HCl – ქლორწყალბადმჟავა (მარილმჟავა), H – Cl Cl (I) HNO2 – აზოტოვანი მჟავა H – O –N = O NO2 (I) H2SO3 – გოგირდოვანი მჟავა SO3 (II) H O S O H O H2SO4 – გოგირდმჟავა SO4 (II) H O O S H O O H3PO4 – ფოსფორმჟავა PO4 (III) H O H O P O H O 2. ა) 3,66 37,94 58,54 n(H) : n(P) : n(O) = : : = 3,66 : 1,22 : 3,66 anu 3 : 1 : 3 1 31 16 ე.ი. H3PO3 ბ) H2CrO4 3. O O CaSO 4 Ca S O O Cl AlCl3 Al Cl Cl O O N O O Fe(NO3)3 Fe O N O O O N O
- 2. O Fe O P O Fe3(PO4)2 Fe O O Fe O P O O O Ba O As O Ba3(AsO4)2 Ba O O Ba O As O O Cl CuCl 2 Cu Cl O O S Cr O O Cr 2(SO4)3 O O S O O Cr O O S O O 4. HF (H) = 5 % (F) = 95% HClO3 (H) = 1,18 % (Cl) = 42,01 % (O) = 56,80 % Mg(NO3)2 (Mg) = 16,22 % (N) = 18,92 % (O) = 64,86 % KBr (K) = 32,77 % (Br) = 67,23 % III ტესტი 1. მარტივი ნივთიერებებია: 1. მხოლოდ მეტალები 2. მხოლოდ აირები
- 3. 3. მხოლოდ არამეტალები 4. მეტალები და არამეტალები 2. რთული ნივთიერებებია: 1. მეტალები, აირები, ოქსიდები 2. არამეტალები, ოქსიდები, მჟავები 3. ნივთიერებები, რომელთა მოლეკულები რამდენიმე ელემენტის ატომს შეიცავენ 4. ერთი ელემენტისგან შედგენილი ნივთიერებები 3. შეერთების რეაქციებს არ მიეკუთვნება: 1. 2H2 + O2 = 2H2O 2. SO3 + H2O = H2SO4 3. 2CO + O2 = 2CO2 4. CaCO3 t0 CaO + CO2 4. მიმოცვლის რეაქციაა 1. HCl + KOH = KCl + H2O 2. Zn + 2HCl = ZnCl2 + H2 t0 3. Cu(OH)2 CuO + H2O 4. 2Na + 2H2O = 2NaOH + H2 5. ჩანაცვლების რეაქციაა: 1. 2HCl + CaCO3 = CaCl2 + H2O + CO2 2. 2H2 + O2 = 2H2O 3. 2Na + 2H2O = 2NaOH + H2 4. 2SO2 + O2 = 2SO3 6. დაშლის რეაქციაა: 1. Fe + CuSO4 = FeSO4 + Cu 2. CaCO3 + 2HCl = CaCl2 + H2O + CO2 3. Zn + 2HCl = ZnCl2 + H2 4. CaCO3 = CaO + CO2 7. ოქსიდებია: 1. CaO, CrO, SO2, SO3 2. Na2O, K2O, CO2, KOH
- 4. 3. NaOH, KOH, Cu(OH)2, Ca(OH)2 4. SO2, SiO2, NaOH, KOH 8. ჰიდროქსიდებია (ფუძეებია): 1. Cu(OH)2, Zn(OH)2, Fe(OH)2, H3BO3 2. NaOH, KOH, Ca(OH)2, Zn(OH)2, Al(OH)3 3. HClO3, H6TeO6, Fe(OH)2, Fe(OH)3 4. HCl, H2SO4, HNO3, H2SO3 9. მარილებია: 1. AgCl, NaCl, Na2SO4, FeSO4 2. NaCl, NaOH, Na2SO4, Na2CO3 3. CaCl2, CaSO4, Ca(NO3)2, Ca(OH)2 4. KCl, KNO3, K2S, KOH 10. წყალში ხსნადი ჰიდროქსიდებია: 1. NaOH, LiOH, Fe(OH)2 2. Cu(OH)2, Fe(OH)2, Fe(OH)3 3. NaOH, KOH, LiOH 4. Na2O, K2O, Li2O არაორგანულ ნივთიერებათა კლასები (გაგრძელება) ჩვენ მიმოვიხილეთ რთულ ნივთიერებათა ოთხივე კლასი. უკვე ვიცით ოქსიდების, მეტალთა ჰიდროქსიდების, მჟავების და მარილების შედგენილობა, გრაფიკული ფორმულები და სახელწოდებები. ახლა გავეცნოთ თითოეული კლასის შესაბამისი ნაერთების მიღების ხერხებს და მათ ფიზიკურ და ქიმიურ თვისებებს. ოქსიდების მიღება, კლასიფიკაცია, ფიზიკური და ქიმიური თვისებები. გავიხსენოთ: ოქსიდები ეწოდებათ ორი ელემენტისაგან შედგენილ რთულ ნივთიერებებს, რომელთაგან ერთი ჟანგბადია. სხვაგვარად ოქსიდებს ელემენტის ჟანგბადნაერთებს (ჟანგეულები) უწოდებენ.
- 5. ოქსიდების მიღების ხერხები. 1. მარტივი ნივთიერებების ჟანგბადთან ურთიერთქმედება. თითქმის ყველა მეტალი და არამეტალი, ზოგი ჩვეულებრივ პირობებში, ზოგი კი გაცხელებისას შედის რეაქციაში ჟანგბადთან. მაგ: 4Li + O2 2Li2O 2Mg + O2 2MgO 4Al + 3O2 2Al2O3 C + O2 CO2 4As + 5O2 2As2O5 S + O2 SO2 2. მეტალთა უხსნადი ჰიდროქსიდების დაშლა გაცხელებისას: t0 Cu(OH)2 CuO + H2O t0 Fe(OH)2 FeO + H2O t0 2Fe(OH)3 Fe2O3 + 3 H2O როგორც ვხედავთ, მეტალის ვალენტობა ჰიდროქსიდსა და შესაბამის ოქსიდში ერთნაირია. t0 სიმბოლო აღნიშნავს, რომ რეაქცია გაცხელებისას წარიმართება. 3. ზოგიერთი მჟავას დაშლა: t0 H2SO3 H2O + SO2 t0 H2SiO3 H2O + SiO2 4. ჟანგბადიანი მჟავას მარილების (კარბონატები, ნიტრატები, სულფიტები და სხვა) დაშლა გაცხელებისას; CaCO3 CaO + CO2 MgSO3 MgO + SO2 ზოგიერთი მარილის დაშლის რეაქციები უფრო რთული გზით მიმდინარეობენ. მაგ: 2Cu(NO3)2 2CuO + 4NO2 + O2 5. ზოგიერთი რთული ნივთიერების წვა: 2ZnS + 3O2 2ZnO + 2SO2 CH4 + 2O2 CO2 + 2H2O ოქსიდების კლასიფიკაცია:
- 6. ოქსიდები იყოფა ორ ჯგუფად: მარილწარმომქმნელ და მარილარწარმომქმნელ ოქსიდებად. მარილარწარმომქმნელი ოქსიდებია – H2O, N2O, NO, CO, SiO. ყველა დანარჩენი ოქსიდი მარილწარმომქმნელია. მარილწარმომქმნელი ოქსიდები იყოფა სამ ჯგუფად: ფუძე, მჟავურ და ამფოტერულ ოქსიდებად. ამ ჯგუფებად დაყოფა ხდება ოქსიდების ქიმიური თვისებების მიხედვით. თუ ოქსიდი რეაგირებს მჟავასთან (HNO3 – აზოტმჟავასთან, HCl – მარილმჟავასთან, H2SO4 – გოგირდმჟავასთან და სხვა) და არ რეაგირებს ტუტეებთან (NaOH – მწვავე ნატრი, KOH – მწვავე კალი), მაშინ ასეთ ოქსიდს ფუძე ოქსიდი ეწოდება. მაგ: MgO ფუძე ოქსიდია, რადგან რეაგირებს მჟავასთან MgO + 2HCl MgCl2 + H2O და არ რეაგირებს ტუტესთან MgO + NaOH ფუძე ოქსიდებია მეტალთა ოქსიდების დიდი ნაწილი. კერძოდ: Li2O, Na2O, K2O, MgO, CaO, BaO, FeO, CrO, CuO, Ag2O, HgO და ა.შ. ფუძე ოქსიდებს ფუძეები შეესაბამება, მაგ: Na2O – NaOH, FeO – Fe(OH)2 და ა.შ. თუ ოქსიდი არ რეაგირებს მჟავებთან და რეაგირებს ტუტეებთან, მაშინ ეს ოქსიდი მჟავურ ოქსიდებს მიეკუთვნება. კერძოდ, მჟავური ოქსიდია CO2, რომელიც არ რეაგირებს მჟავებთან, მაგრამ რეაგირებს ტუტეებთან. CO2 + HCl CO2 + 2KOH K2CO3 + H2O მჟავური ოქსიდებია არამეტალთა ოქსიდები. მაგ: SO2, SO3, N2O3, NO2, N2O5, P2O5, As2O5, CO2, SiO2. მჟავური ოქსიდებია აგრეთვე ზოგიერთი მეტალის ოქსიდი, რომლებშიც მეტალები მაღალ ვალენტობას ამჟღავნებენ. მაგ: MnO3, Mn2O7, CrO3 და ა.შ. მჟავურ ოქსიდებს მჟავები შეესაბამება, მაგ: SiO2 – H2SiO3, SO3 – H2SO4 და ა.შ. ზოგიერთი მეტალის ოქსიდი რეაგირებს როგორც მჟავასთან, ისე ტუტესთან. Aასეთ ოქსიდებს ამფოტერულ ოქსიდებს უწოდებენ. ამფოტერული ოქსიდია ZnO. ის რეაგირებს მჟავასთანაც და ტუტესთანაც: ZnO + 2HCl ZnCl2 + H2O ZnO + 2KOH K2ZnO2 + H2O მჟავასთან ურთიერთქმედებისას ZnO ამჟღავნებს ფუძე ოქსიდის თვისებებს, ხოლო ტუტეებთან ურთიერთქმედებისას – მჟავური ოქსიდის თვისებებს. ZnO-ს გარდა ამფოტერული ოქსიდებია: Al2O3, BeO, Cr2O3, SnO2, PbO2 და ა.შ.
- 7. საშინაო დავალება: 1. დაწერეთ მარტივ ნივთიერებათა და ჟანგბადის ურთიერთქმედების რეაქციები. გამოიყენეთ Li, K, Be, Ca, Mg, Zn, Hg, Pb, Sn, B, Si, As. (ამ ელემენტთა ვალენტობა თუ არ გვახსოვს შეგვიძლია ამჯერად ვისარგებლოთ #1 ცხრილით). 2. დაწერეთ მეტალთა ჰიდროქსიდების, მჟავების და მარილების დაშლის რეაქციები. გამოიყენეთ BaCO3, CaSO3, CuSO3, ZnSO3, ZnCO3, Cu(OH)2, CuOH, Fe(OH)2, Fe(OH)3, H2SO3, H2SO4.
