Solidos cristalinos
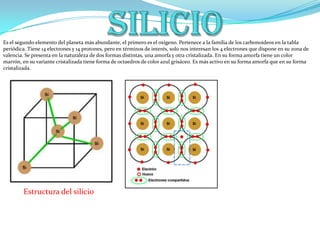
- 1. Silicio Es el segundo elemento del planeta más abundante, el primero es el oxígeno. Pertenece a la familia de los carbonoideos en la tabla periódica. Tiene 14 electrones y 14 protones, pero en términos de interés, solo nos interesan los 4 electrones que dispone en su zona de valencia. Se presenta en la naturaleza de dos formas distintas, una amorfa y otra cristalizada. En su forma amorfa tiene un color marrón, en su variante cristalizada tiene forma de octaedros de color azul grisáceo. Es más activo en su forma amorfa que en su forma cristalizada. Estructura del silicio
- 2. El silicio representa un 25,7 % del peso total de la cortezaterrestre y es el segundo elemento más abundante, despuésdel oxígeno. Está presente en el Sol y en las estrellas, y estambién el principal componente de los meteoritos conocidoscomo aerolitos.En la tabla periódica, el silicio ocupa el número 14, que es sunúmero atómico, y se representa por el símbolo Si. Es sólidoa temperatura ambiente, y tiene un color gris azulado. Seconsidera un elemento semi- metálico. El átomo de silicio posee cuatro cargas eléctricas positivas, Si4+. Sabemos que las cargas positivas y negativas se atraen. Por lo tanto, el Silicio puede unirse a otros átomos, de manera que cada carga positiva sea compensada por una carga negativa de otro elemento. El oxígeno, por su parte, posee dos cargas negativas. En cada palillo clavamos un ión de oxígeno, y ya tenemos el tetraedro de silicio. Hacemos varios tetraedros
- 3. EL RADIO IÓNICO Y LA COORDINACIÓN En nuestro modelo anterior, hemos ignorado el tamaño de los átomos. Sin embargo, este juega un papel muy importante en la combinación de los átomos para formar minerales. El tamaño de cada átomo, junto con las cargas eléctricas que posee, hace que éste ejerza su atracción en un determinado radio de acción alrededor del átomo. Este radio es el radio iónico. Así, mientras el átomo de silicio es más grande que el átomo de oxígeno, el radio iónico del silicio (0,39 Å) es casi cuatro veces más pequeño que el radio iónico del oxígeno (1,40 Å). Sus propiedades son intermedias entre las del carbono y el germanio. En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja. El silicio constituye un 28% de la corteza terrestre. No existe en estado libre, sino que se encuentra en forma de dióxido de silicio y de silicatos complejos. Los minerales que contienen silicio constituyen cerca del 40% de todos los minerales comunes, incluyendo más del 90% de los minerales que forman rocas volcánicas. El mineral cuarzo, sus variedades
- 4. GERMANIO Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis. Los elementos químicos de la familia del Carbono, que agrupa además del citado al Silicio, Germanio, Estaño y Plomo, poseen unas estructuras atómicas que los convierten en potentes comodines combinacionales. A medida que su peso atómico es creciente, su estado de agregación varía desde el gaseoso para el Carbono hasta el metálico del resto, aunque Silicio y Germanio suelen considerarse semimetales.
- 5. CARACTERISTICAS PRINCIPALES Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, deleznable, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis. Forma gran número de compuestos órgano-metálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad. Germanio Símbolo químico Ge Número atómico 32 Grupo 14 Periodo 4 Aspecto blanco grisáceo Bloque p Densidad 5323 kg/m3 Masa atómica 72.64 u Radio medio 125 pm Radio atómico 125 Radio covalente 122 pm Configuración electrónica [Ar]3d10 4s2 4p2 Electrones por capa 2, 8, 18, 4 Estados de oxidación 4 Óxido anfótero Estructura cristalina cúbica centrada en las caras Estado sólido Punto de fusión 1211.4 K Punto de ebullición 3093 K Calor de fusión 36.94 kJ/mol Presión de vapor 0,0000746 Pa a 1210 K Electronegatividad 2,01 Calor específico 320 J/(K·kg) Conductividad eléctrica 1,45 S/m Conductividad térmica 59,9 W/(K·m)
- 6. Propiedades químicas del Germanio- Efectos del hidruro de Germanio y el tetrahidruro de Germanio sobre la salud - Efectos ambientales del GermanioNombre: Germanio Número atómico: 32 Valencia : 4 Estado de oxidación: +4 Electronegatividad : 1,8 Radio covalente (Å): 1,22 Radio iónico (Å): 0,53 Radio atómico (Å) : 1,37 Configuración electrónica : [Ar]3d104s24p2 Primer potencial de ionización (eV): 8,16 Masa atómica (g/mol) : 72,59 Densidad (g/ml) : 5,32 Punto de ebullición (ºC) : 2830 Punto de fusión (ºC): 937,4 Descubridor : Clemens Winkler 1886
- 7. GALIO El galio es un metal blando, grisáceo en estado líquido y plateado brillante al solidificar, sólido deleznable a bajas temperaturas que funde a temperaturas cercanas a la de la ambiente (como cesio, mercurio y rubidio) e incluso cuando se lo agarra con la mano por su bajo punto de fusión (28,56 °C). El rango de temperatura en el que permanece líquido es uno de los más altos de los metales (2174 °C separan sus punto de fusión y ebullición) y la presión de vapor es baja incluso a altas temperaturas. El metal se expande un 3,1% al solidificar y flota en el líquido al igual que el hielo en el agua. Elemento químico, símbolo Ga, número atómico 31 y peso atómico 69.72. lo descubrió Lecoq de Boisbaudran en Francia en 1875. Tiene un gran intervalo de temperatura en el estado líquido, y se ha recomendado su uso en termómetros de alta temperatura y manómetros. En aleación con plata y estañó, el galio suple en forma adecuada la amalgama en curaciones dentales; también sirve para soldar materiales no metálicos, incluyendo gemas o amtales. El arseniuro de galio puede utilizarse en sistemas para transformar movimiento mecánico en impulsos eléctricos. Los artículos sintéticos superconductores pueden prepararse por la fabricación de matrices porosas de vanadio o tántalo impregnados con hidruro de galio. El galio ha dado excelentes resultados como semiconductor para uso en rectificadores, transistores, fotoconductores, fuentes de luz, diodos láser o máser y aparatos de refrigeración.
- 8. La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el mercurio dentro de la tabla periódica de los elementos, el mercurio se encuentra en el grupo 13 y periodo 4. El galio tiene una masa atómica de 69,723 u. La configuración electrónica del galio es [Ar]3d10 4s2 4p1. La configuración electrónica de los elementos, determina la forma el la cual los electrones están estructurados en los átomos de un elemento. El radio medio del galio es de 1,0 pm, su radio atómico o radio de Bohr es de 1,6 pm, su radio covalente es de 1,6 pm y su radio de Van derWaals es de 1,7 pm. El galio tiene un total de 31 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones y en la cuarta, 3 electrones. UNO DE LOS METALES menos conocidos, el galio, presenta características extremadamente singulares y es desde hace años un enigma para los expertos. Como el galio lo mismo es sólido que líquido, los técnicos no saben en qué emplearlo. Cuando se le da la forma de una moneda, se asemeja mucho a uno de estos codiciados discos, pero al cogerla con la mano el calor hace que se derrita; El galio es lo suficientemente fuerte para hacer clavos, pero, a los primeros síntomas de calor, se derrite como una vela. Su punto de fusión es 29.5 grados centígrados. Al solidificarse se parece a la plata; cuando se derrite se asemeja al mercurio
- 9. Es un termómetro higiénico de cristal con una aleación de galio como líquido medidor.El aspecto de la aleación es parecido al del mercurio, pero totalmente inocuo y no tóxico.El revestimiento de cristal puede desinfectarse, lo que permite proceder a las mediciones de manera higiénica.Termómetro que permite una medición exacta sin necesidad de pilas ni de calibraciones. Para desecharlo puede tirarse directamente a la basura.Mide la temperatura de 35 a 42 grados. La moneda de galio se escurre por entre los dedos, al derretirse rápidamente con el calor de la mano
- 10. REFERENCIAS http://www.profes.net/rep_documentos/Propuestas_2%C2%BA_ciclo_ESO/El_silicio_y_sus_propiedades.PDF http://docs.google.com/viewer?a=v&q=cache:nX2aoojisI8J:https://www.upo.es/depa/webdex/quimfis/miembros/Web_Sofia/TABLA/Ge.ppt+aplicaciones+del+germanio&hl=es&gl=pe&pid=bl&srcid=ADGEESgixkj14GdHphkx8tDZZDCLUZdz36jxpJ5s3ijUsDyH8yXDn9RHDDvz1SpmQrsKNfMaZIGyYm1DZlw28KF6QdDAQtkYlBV5aQgNR_tO5Dgh7-4g3xyxacj9f_ojZQ11y-iskIcr&sig=AHIEtbRrzRLSjAcfOOfPXxi6o0k4rUJlYg http://es.wikipedia.org/wiki/Galio http://www.lenntech.es/periodica/elementos/ga.htm http://www.textoscientificos.com/quimica/cristales/estructura-cristalina http://www.lenntech.es/periodica/elementos/si.htm http://www.profes.net/rep_documentos/Propuestas_2%C2%BA_ciclo_ESO/El_silicio_y_sus_propiedades.PDF http://www.enbuenasmanos.com/articulos/muestra.asp?art=1916 www.tarot-josnell.com/vitaminas/silicio.htm http://es.wikipedia.org/wiki/Germanio http://elementos.org.es/germanio es.wikipedia.org/wiki/Galio http://elementos.org.es/galio