Equilibrio químico: Reacciones reversibles e irreversibles
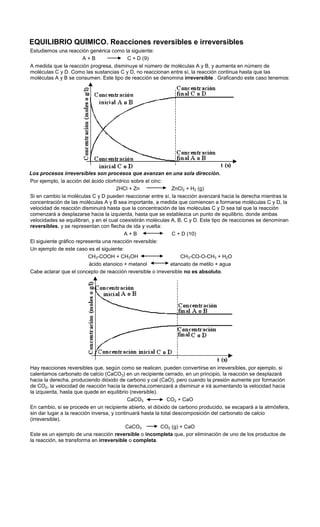
- 1. EQUILIBRIO QUIMICO. Reacciones reversibles e irreversibles<br />Estudiemos una reacción genérica como la siguiente:<br /> A + B C + D (9)<br />A medida que la reacción progresa, disminuye el número de moléculas A y B, y aumenta en número de moléculas C y D. Como las sustancias C y D, no reaccionan entre sí, la reacción continua hasta que las moléculas A y B se consumen. Este tipo de reacción se denomina irreversible . Graficando este caso tenemos:<br />Los procesos irreversibles son procesos que avanzan en una sola dirección.<br />Por ejemplo, la acción del ácido clorhídrico sobre el cinc:<br />2HCl + Zn ZnCl2 + H2 (g)<br />Si en cambio la moléculas C y D pueden reaccionar entre sí, la reacción avanzará hacia la derecha mientras la concentración de las moléculas A y B sea importante, a medida que comiencen a formarse moléculas C y D, la velocidad de reacción disminuirá hasta que la concentración de las moléculas C y D sea tal que la reacción comenzará a desplazarse hacia la izquierda, hasta que se establezca un punto de equilibrio, donde ambas velocidades se equilibran, y en el cual coexistirán moléculas A, B, C y D. Este tipo de reacciones se denominan reversibles, y se representan con flecha de ida y vuelta:<br />A + B C + D (10)<br />El siguiente gráfico representa una reacción reversible:<br />Un ejemplo de este caso es el siguiente:<br />CH3-COOH + CH3OH CH3-CO-O-CH3 + H2O<br />ácido etanoico + metanol etanoato de metilo + agua<br />Cabe aclarar que el concepto de reacción reversible o irreversible no es absoluto.<br />Hay reacciones reversibles que, según como se realicen, pueden convertirse en irreversibles, por ejemplo, si calentamos carbonato de calcio (CaCO3) en un recipiente cerrado, en un principio, la reacción se desplazará hacia la derecha, produciendo dióxido de carbono y cal (CaO), pero cuando la presión aumente por formación de CO2, la velocidad de reacción hacia la derecha,comenzará a disminuir e irá aumentando la velocidad hacia la izquierda, hasta que quede en equilibrio (reversible).<br />CaCO3 CO2 + CaO<br />En cambio, si se procede en un recipiente abierto, el dióxido de carbono producido, se escapará a la atmósfera, sin dar lugar a la reacción inversa, y continuará hasta la total descomposición del carbonato de calcio (irreversible).<br />CaCO3 CO2 (g) + CaO<br />Este es un ejemplo de una reacción reversible o incompleta que, por eliminación de uno de los productos de la reacción, se transforma en irreversible o completa.<br />