Aromaticos
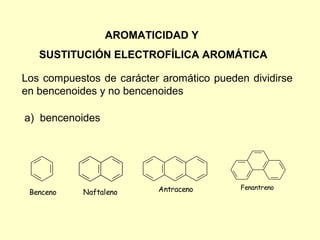
- 1. AROMATICIDAD Y SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA Los compuestos de carácter aromático pueden dividirse en bencenoides y no bencenoides a) bencenoides Antraceno Fenantreno Benceno Naftaleno
- 2. b) No bencenoides N N H Azuleno Piridina Pirrol anión catión ciclopentadienilo cicloheptatrienilo
- 3. Nomenclatura de compuestos derivados del benceno a) Nombres triviales
- 4. IUPAC, acepta estos nombres no sistemáticos. Pero nombre sistemático de estos compuestos, lo define IUPAC como la combinación del nombre del sustituyente como prefijo del nombre benceno. Así por ejemplo : Sustituyente Grupo Nombre del Nombre común funcional. compuesto. Hidroxi -OH Hidroxibenceno Fenol Amino -NH2 Aminobenceno Anilina Etenil -CH=CH2 Etenilbenceno Estireno
- 5. • Cuando el anillo benceno está como sustituyente, su nombre es fenil, y el carbono de la valencia libre es el Nº1; otros sustituyentes aromaticos son:
- 6. • Benceno disustituido: Cuando sobre el anillo hay más de un sustituyente, aparecen diferentes estructuras isoméricas: En general estos isómeros se abrevian con una letra: o- de orto, m- de meta y p-de para.
- 7. Hay veces en que se combina esta regla de la disustitución o, m, p con nombres comunes no sistemáticos. Por ejemplo: OH ISÓMERO SUSTITUCIÓN NO2 o-nitrofenol (1-2) ORTO NH2 m-cloroanilina (1-3) META Cl CO 2H ácido p-hidroxibenzoico (1-4) PARA OH
- 8. Cuando hay más de dos sustituyentes en el benceno, se numera el núcleo aromático siguiendo el sentido que dé a los sustituyentes la menor numeración posible. Además, hay que respetar la precedencia de los grupos funcionales. OH NH2 1 2 NO2 1 3 5 3 4 Cl H3C NH2 4-amino-2-nitrofenol 3-cloro-5-metilanilina y no 4-hidroxi-3-nitroanilina y no 3-amino-5-clorotolueno
- 9. CO2H OH 1 3 NH2 2 Br 2 5 1 O 2N 4 CHO OH ácido 2-bromo-4-hidroxi-5-nitrobenzoico 2-amino-3-hidroxibenzaldehido Observe que se ha dado la numeración 1, al carbono perteneciente al anillo que tiene unida la función química más importante entre los sustituyentes, es decir, la función que tiene la mayor precedencia en química orgánica. Esta función prioritaria, nos informa, a qué familia química pertenece la molécula que tenemos delante. El sentido de la numeración, sigue el mismo criterio citado ya, es decir, darle al resto de los sustituyentes, la menor numeración posible. En el nombre final, estos se ordenan según orden alfabético.
- 10. REACCIONES QUÍMICAS DEL BENCENO • 1.- Nitración • 2.- Halogenación • 3.- Sulfonación • 4.- Alquilación • 5.- Acilación.
- 11. Nitración H2SO4 + HNO3 H2NO3 + HSO4 H2NO 3 H2O + NO 2 H NO 2 lento + NO 2 H NO 2 NO 2 rápido + HSO 4 + H2SO 4 nitrobenceno
- 12. halogenación H lento + Cl Cl FeCl3 Cl + FeCl4 H Cl rápido Cl + FeCl4 + HCl + FeCl3
- 13. sulfonación 2 H2SO4 H3SO4 + HSO4 H3SO4 H3O + SO3 H SO3 lenta + SO3 lenta
- 14. H SO3 SO3 lento + HSO4 + H2SO4 lento SO3 SO3H rápido + H3O + H2O rápido ácido benceno sulfónico T1 T2 H SO 3 E React. Product. coordenada de reacción
- 15. ALQUILACION DE FRIEDEL Y CRAFTS. R + R X + H X
- 16. Calores de hidrogenación de cicloalquenos Compuesto Producto ΔH(kcal) Ciclohexeno - 28,6 1,3-Ciclohexadieno Ciclohexano - 55,4 1,3,5- - 49,8 Ciclohexatrieno Según la tabla, por cada doble enlace que se hidrogene se debieran desprender 28,6 kcal. Así, para el benceno (tres dobles enlaces), el ΔH debiera ser de – 85,8 kcal. El valor observado es de –49,8 kcal, luego 85,8 – 49,8 = 36 kcal menos que lo esperado, lo que equivale a la energía de estabilización o de resonancia
- 17. + 3 H2 85,8 + 2 H2 36,0 57,2 1,8 55,4 49,8 + H2 28,6
- 18. Espectroscópicamente, se ha determinado que: a) Todos los enlaces C–C tienen la misma longitud (1,39 Å) que es intermedia entre un enlace simple (1,54Å) y uno doble (1,34Å) b) Todos los ángulos de enlace C-C-C son de 120º Esto último sugiere que todos los carbonos están hibridizados sp2, luego la estructura básica del benceno considera un anillo plano de 6 átomos de carbono. En cada uno de ellos hay un orbital p . Como la distancia C-C es la misma y pequeña (1,39Å), los orbitales p pueden superponerse efectivamente formando una nube electrónica homogenea.
- 19. Regla de Huckel En 1931, E. Huckel,mediante cálculos teóricos, estableció que los anillos monocíclicos planos que tienen (4n + 2) electrones π poseen una alta estabilidad termodinámica (alta energía de resonancia). Esta propiedad se denomina aromaticidad Aromáticos ( 6, 10, 14 electrones π ) No aromáticos 4, 8, electrones π, etc
- 20. Algunos ciclos a pesar de cumplir con la regla de (4n + 2) electrones π, no son aromáticos porque no son planos. H H Los H señalados impiden la coplanaridad del anillo, por lo tanto los orbitales p no se superponen con eficiencia y la molécula aumenta su energía. El naftaleno (a la derecha) no presenta ese problema y es aromático.
- 21. Iones aromáticos catión anión catión ciclopropenilo ciclopentadienilo cicloheptatrienilo Ambos son aromáticos porque tienen (4n + 2) electrones π conjugados en un ciclo, lo que implica máxima superposición de sus orbitales p. Azuleno
- 22. La conjugación es requisito indispensable para la condición de aromático. Un anillo puede tener (4n + 2) electrones π y no ser aromático porque la conjugación está interrumpida, por ejemplo C sp3 C sp3 H Heterocíclicos aromáticos H .. .. .. .. O S N: N .. Piridina Furano Tiofeno Pirrol
- 23. Pirrol y piridina H N: N .. Pirrol Piridina El pirrol es aromático porque utiliza el par de electrones no compartidps sobre el N para completar 6 electrones en la nube π; en cambio la piridina no los necesita ya que en cada orbital p tiene un electron ( 6 en total). . . . .. . . . H N. . .. N . .
- 24. Teoría de la sustitución electrofílica aromática El benceno, a pesar de su alta insaturación, no da reacciones de adición sino de sustitución En este tipo de reacciones se produce la sustitución de una especie unida al anillo aromático por otra especie electrofílica similar. El electrófilo que se desplaza comúnmente es H+ Las especies electrofílicas más comunes son Br+ ; SO3 ; NO2+ y R+.
- 25. El mecanismo de esta reacción involucra dos etapas: en la primera etapa (lenta) el electrófilo atacante se une al anillo formando cationes ciclohexadienilos (complejos σ). + E E E E H H H (complejos σ).
- 26. En la segunda etapa (rápida) se pierde un electrófilo del mismo carbono que sufrió el ataque del electrófilo reactivo, regenerándose el sistema aromático conjugado E E + H H 1.- Halogenación Se puede reemplazar un H del anillo por Br o Cl por reacción con Br2 o Cl2, pero en presencia de un ácido de Lewis (FeBr3 o AlCl3 respectivamente). El reemplazo por I (yodo) se produce por una reacción diferente, que se analizará más adelante.
- 27. La molécula de un halógeno es apolar, por lo tanto es poco reactiva con el sistema π del anillo aromático. Cuando se agrega el ácido de Lewis adecuado, se polariza el enlace X-X, formándose los complejos Fe Br 4 Br AlCl4 Cl donde los electrófilos son Br+ y Cl+ y los aniones FeBr4- y AlCl4- actúan como bases para transformar el complejo σ en el producto sustituido Bromación y cloración presentan un perfil de energía como el que se muestra a continuación
- 28. Br H Br 2 1 + Br2 + HBr 1 2 Ea H Br Br + Br2 + HBr
- 29. 2. Nitración Si un alqueno se trata con HNO3, se puede oxidar el doble enlace por el gran poder oxidante del ácido nítrico. La alta estabilidad del anillo aromático permite la reacción de nitración sin que ocurra la oxidación del sistema insaturado se consigue una buena reacción usando una mezcla de HNO3 y H2SO4 , donde el electrófilo es NO2+. NO2 H2SO4 + HNO3 + H2O
- 30. 3. Sulfonación En esta reacción reversible, el benceno reacciona con H2SO4 fumante (H2SO4 + SO3 disuelto) SO3 H + H2SO4 + H2O
- 31. 4. Alquilación de Friedel y Crafts Resulta de la reacción de un un anillo aromático con un halogenuro de alquilo, el que en presencia de AlCl3, por un mecanismo similar al de la halogenación, genera una especie (carbocatión) que actúa como electrófilo R AlCl3 + R X + HX R X + AlCl3 R AlCl3X H R H + AlCl3X R AlCl3X R + HX + AlCl3
- 32. Ejemplo: CH3 CH3 AlCl3 + CH3 C Cl C CH3 + HCl CH3 CH3 Otra formación de carbocationes CH3 HF + CH3 CH CH2 CH CH3 0º C H CH3 CH CH2 + HF CH3 C CH3
- 33. Estabilidad de carbocationes CH3 H H H CH3 C > CH3 C > CH3 C > H C CH3 CH3 H H Esto se explica por el efecto dador de electrones de los radicales alquilo (CH3, CH3CH2, etc) que disminuye la carga sobre el átomo que la soporta. Como la carga queda repartida sobre más átomos, la molécula es más estable.
- 34. Limitaciones de la reacción de alquilación de Friedel y Crafts 1.- Como transcurre a través de un carbocatión intermediario, se producen reordenamientos si el carbocatión formado inicialmente es de baja estabilidad CH3 CH3 CH2CH2CH3 CH AlCl3 + CH3 CH2 CH2Cl + 30% 70% AlCl3 reordenamiento CH3CH2CH2Cl CH3CH2CH2 CH3CHCH3 (1º, inicial) (2º, más estable)
- 35. 2.- Se pueden producir polialquilaciones, ya que al introducir un radical alquilo (dador de electrones) el producto se hace más reactivo que el compuesto aromático inicial CH 3 CH 3 CH3 CH3 CH CH CH 3 AlC l3 + CHCl + CH3 CH CH 3 CH3 Para reducir esta reacción lateral, es conveniente trabajar con exceso del compuesto aromático inicial, para que el halogenuro reaccione principalmente con él.
- 36. 5.- Reacción de acilación Debido a los inconvenientes de la reacción de alquilación, es preferible introducir en primera instancia grupos acilo (R-C=O) porque no sufren reordenamientos y no dan reacciones de polialquilación por ser atractores de electrones. Después se reduce a hidrocarburo el grupo carbonilo formado. O R O C CH2 R R C Cl Zn(Hg) AlCl3 HCl
- 37. O R COOH + SOCl2 R C + SO2 + HCl Cl Aplicación de la reacción de acilación O O AlCl3 + CH3 CH2 C C CH2 CH3 (90%) Cl O Zn(Hg) C CH2 CH3 CH2 CH2 CH3 (80%) HCl reflujo
- 38. Reactividad y orientación En relación al benceno, un sustituyente presente en un anillo aromático afecta a una nueva sustitución electrofílica de dos maneras: a) Aumenta la velocidad de la reacción si el sustituyente presente es un dador de electrones y la disminuye si es aceptor de electrones y depende de la magnitud de su efecto eléctrico R (CH3, NH2,...) R (NO2, C=O, CN,...) velocidad de reacción
- 39. Esto significa que un anillo aromático que presenta un sustituyente dador de electrones (activador) es más reactivo que el benceno hacia una nueva sustitución electrofílica, ya que tiene mayor densidad electrónica Un compuesto aromático que presenta un sustituyente aceptor de electrones (desactivador) es menos reactivo que el benceno hacia una nueva sustitución electrofílica ya que tiene menor densidad electrónica
- 40. Reactividad O O NH2 OCH3 CH3 F Br C H C OH SO3H NO2 O O OH NHCOCH3 Cl I CN H NR3 C OR C R Activadores Desactivadores b) Un sustituyente presente en el anillo determina la orientación de la nueva sustitución, es decir, la posición del anillo donde se producirá la sustitución electrofílica
- 41. De acuerdo a la orientación de la nueva sustitución, los sustituyentes se clasifican en orientadores orto- para y orientadores meta Orientadores orto - para Orientadores meta Fuertemente activadores Fuertemente desactivadores NH2 ; NHR , NR2.. OH NR3+ , NO2 , CCl3 Moderadamente activadores Moderadamente desactivadores NHCOR.., OR. CN..,..SO3H..,..COOR.., COR Débilmente activadores CH3..,..CH3 CH2.., C6H5 Débilmente desactivadores Halógenos
- 42. La teoría de la resonancia explica la orientación en la sustitución electrofílica aromática Los sustituyentes pueden clasificarse en dos tipos a) con pares de electrones no compartidos en el átomo principal. Ejemplo .. .. .. . NR2 OR X. .. (Halógenos) .. la resonancia de sus electrones con un sistema conjugado origina diversas estructuras resonantes .. .. .. .. . OR OR OR OR 2 6 4
- 43. Se observa que la mayor densidad electrónica se encuentra en los carbonos 2, 4 y 6 del sistema conjugado en relación con la posición del sustituyente Luego, un electrófilo atacará preferentemente esas posiciones (orto y para) Nótese que los halógenos pese a tener un efecto inductivo mayor que el de resonancia, orientan la sustitución electrofílica a las posiciones orto y para, es decir la orientación está definida por el efecto de resonancia
- 44. b) con dos átomos unidos entre sí por un enlace múltiple en el que el átomo más alejado del sistema conjugado es más electronegativo Se puede resumir sus estructuras como X=Y o X≡Y , donde Y es más electronegativo que X X Y X Y X Y X Y 2 6 4 La resonancia también afecta las posiciones 2, 4 y 6 del sistema conjugado (en relación al sustituyente) pero la mayor densidad electrónica está en las posiciones 3y5 Luego un electrófilo atacará preferentemente en la posición meta
- 45. Ejemplos CH3 CH3 CH3 NO2 HNO3 (37%) (59%) + H2SO4 NO2 Br Br Br Cl2 Cl (45%) + (53%) FeCl3 Cl COOH COOH COOH COOH NO2 HNO3 + + H2SO4 NO2 19% NO2 80% 1% CF3 CF3 HNO3 (100%) H2SO4 NO2
- 46. Sustituyente orto meta para Sustituyente orto meta para Desactivadores orientadores meta Desactivadores orientadores orto-para (CH3)N+ 2 89 11 F 13 1 86 NO2 7 91 2 Cl 35 1 64 COOH 22 77 2 Br 43 1 56 CO2Et 28 66 6 I 45 1 54 COCH3 26 72 2 Activadores orientadores orto-para CHO 19 72 9 CH3 63 3 34 CN 17 81 2 OH 50 0 50 NHCOCH3 19 2 79
- 47. Orientación de la sustitución electrofílica en bencenos disustituidos a) Si la disustitución es 1,4 y ambos sustituyentes orientan a la misma posición se obtiene un solo producto CH3 Br NO2 Br b) Si la disustitución es 1,4 y ambos sustituyentes orientan a distintas posiciones, predomina la influencia orientadora del grupo más activador CH3 OH
- 48. c) si la disustitución es 1,2 o 1,3 es habitual la formación de mezclas de isómeros trisustituidos disustitución 1,2 CH3 CH3 CH3 CH3 CH3 Cl HNO3 Cl Cl Cl O2N Cl + + + H2SO4 NO2 O2N NO2 19% 17% 43% 21% disustitución 1,3 Cl Cl Cl Cl O2N NO2 HNO3 + + H2SO4 Br Br Br Br NO2 62% 37% 1%
- 49. Algunas reacciones de cadenas laterales Halogenación R R R C H R C Br (Cl) NBS (Cl2, UV) CH2 CH3 CHCl CH3 CH2 CH2Cl Cl2 + 0º C /UV 91% 9%
- 50. Oxidación En cadenas laterales con al menos 1 enlace C - H R R C H COOH 1. KMnO4 + otros productos OH , calor de oxidación 2. H3O CH3 CH2CH3 CH2CH2CH3 COOH 1. KMnO4 así ó ó OH , calor 2. H3O CH3 CH3 C CH3 1. KMnO4 No hay oxidación OH , calor 2. H3O
- 51. Reducción del grupo NO2 Al tratar un compuesto nitrado con un metal y un ácido mineral, el grupo nitro se reduce a amino. NO2 NH2 1. Fe + HCl (H2) 2. NaOH, H2O CH3 CH3 Cuando el grupo nitro está en presencia de otros grupos susceptibles de reducirse (por ej. C=O) es preferible usar SnCl2 NO NH 2 2 1. SnCl2, H3O O O 2. NaOH, H2O C C H H
- 52. Las aminas primarias aromáticas pueden originar diversos compuestos por reacción del grupo amino con HNO2 (NaNO2 + HCl) formando una sal de diazonio. NH2 N N N N NaNO2 Cl HCl cloruro de bencenodiazonio Esta reacción es compatible con una gran variedad de grupos funcionales Las sales de diazonio son muy inestables (incluso algunas son explosivas) y recién preparadas, en solución acuosa, pueden ser reemplazadas por una gran variedad de nucleófilos
- 53. H I H3PO2 KI Br OH H3O N N N N HBr Cl CuBr KCN CN HCl CuCN Cl CuCl
- 54. Protección del grupo amino. En general, es necesario hacerlo debido a: a) Su fuerte poder activador NH2 NH2 Br Br Br2 ( + 100%) - H3O+ Br b) Su poderoso efecto +M provoca una rápida oxidación del anillo aromático c) La reacción con ácidos genera una sal de amonio que altera la orientación en una sustitución electrofílica NH NH NH3 2 3 HNO3 HNO3 H2SO4 H2SO4 NO2
- 55. Para evitar estas reacciones indeseadas, es preferible utilizar la amida correspondiente para regenerar el grupo amino por hidrólisis O CH3 CH3 NH2 O O NH2 CH3 NH O Reacciones H2O R Amina Amida Hidrólisis Amina final La función amida orienta la SE a las mismas posiciones que el grupo amino, pero es un activador más moderado debido a la presencia del grupo carbonilo que atrae los electrones del NH2.
- 56. Reducción selectiva La reducción de los grupos nitro del m-dinitrobenceno puede ser total o parcial NH2 Zn (Fe) + HCl NO2 NH2 NO2 NO2 (NH4)2Sx NH2 Esto permite el reemplazo total o parcial de los grupos NH2 (provenientes de la reducción del grupo NO2 ) a través de la sal de diazonio correspondiente
- 57. Ejemplos NO2 NH2 Br Zn NaNO2 HBr HCl HCl CuBr NO2 NH2 Br NO2 NH2 Br Br 1- Zn + HCl (NH4)2Sx NaNO2 HBr 2.- NaNO2 / HCl HCl CuBr 3. HCl / CuCl NO2 NO2 NO2 Cl
- 58. Síntesis de compuestos aromáticos Síntesis de ácido p-nitrobenzoico a partir de benceno o tolueno CH3 COOH ó NO2 Estrategia de síntesis 1.- ¿Se puede partir de COOH NO2 ? ó
- 59. La respuesta es no, ya que en cada uno de ellos hay un sustituyente orientador a la posición meta (COOH y NO2) Como en el producto ambos sustituyentes están en la posición para, por lo menos uno de ellos, inicialmente era un orientador orto-para que después sufrió una transformación química, transformándose en un orientador meta El análisis de los grupos presentes indica que, lo más probable es que el grupo carboxilo provenga de la oxidación de un grupo alquilo presente en un anillo que ya tenía incorporado el grupo nitro (inerte a la oxidación) CH3 COOH 1. KMnO4 OH calor 2. H3O NO2 NO2
- 60. Luego, el reactivo inicial es el tolueno, que por nitración da p-nitrotolueno CH3 CH3 HNO3 H2SO4 NO2 y el esquema de la síntesis es CH3 CH3 COOH HNO3 1. KMnO4 H2SO4 OH calor 2. H3O NO2 NO2
