Formación y nomenclatura de óxidos, bases, ácidos y sales
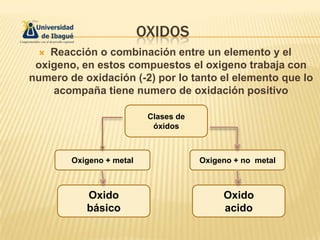
- 1. OXIDOS Reacción o combinación entre un elemento y el oxigeno, en estos compuestos el oxigeno trabaja con numero de oxidación (-2) por lo tanto el elemento que lo acompaña tiene numero de oxidación positivo Clases de óxidos Oxigeno + metal Oxigeno + no metal Oxido básico Oxido acido
- 2. REACCIONES PARA LA FORMACION DE OXIDOS El oxigeno es uno de los elementos mas abundantes de la naturaleza, es además el segundo mas fuerte después del Flúor (3.98 de electronegatividad) por lo tanto tiene una gran facilidad de unirse por enlace iónico con los metales y covalente polar con la mayoría de los no metales; el oxígeno se encuentra en la naturaleza en forma diatómica (O2), por lo tanto se representa de la siguiente manera: Na + O2 Na2O Mg + O2 MgO
- 3. EJERCICIOS DE CONSTRUCCION Y NOMENCLARA DE OXIDOS IDENTIFIQUE LA CLASE OXIDO, EL NUMERO DE OXIDACION Y EL NOMBRE PARA LOS SIGUIENTES OXIDOS Cs2O CO Sb2O5 MgO Ag2O MnO2 CO2 Cr2O3 ZnO Al2O3 PbO PbO2 CoO Rb2O Cl2O SO3
- 4. FORMACIÓN DE BASES O HIDROXIDOS Una base o hidróxido es un compuesto que resulta de combinar un OXIDO BASICO con AGUA, por lo tanto en una base se distingue un metal, el oxígeno y el hidrógeno, estos últimos formando el grupo HIDROXILO (OH) con valor eléctrico (-1) por consiguiente el metal debe tener numero de oxidación positivo (+) Na2O + H2O 2 NaOH
- 5. FORMACION Y NOMENCLATURA DE BASES O HIDROXIDOS NaOH Mg(OH)2 Ca(OH )2 Al(OH)3 Zn(OH )2 RbOH Pb(OH )4 AgOH Au(OH )3 CsOH Ni(OH) 2 Fe(OH)3
- 6. FORMACION DE ACIDOS OXACIDOS Un acido oxácido es un compuesto que resulta de combinar un oxido ácido con el agua, por lo tanto en los ácidos oxácidos se distinguen el hidrógeno, el no metal y el oxigeno Completar: CO2 + H2O Cl2O3 + H2O SO3 + H20 H2SO4
- 7. COMO SE NOMBRAN LOS ACIDOS OXACIDOS Para nombrar los ácidos OXACIDOS ( tienen oxigeno) se utiliza la regla antigua ( IUPAC )de las terminaciones teniendo en cuenta los números de oxidación ( ver Tabla) Números de oxidación Terminaciones Ejemplos Nombres Dos números De oxidación OSO ( Menor) H2CO2 Acido CarbonOSO ICO (Mayor) H2CO3 Acido CarbonICO Tres números De oxidación Hipo-OSO (Menor) H2SO2 Acido Hipo SulfurOSO OSO (intermedio) H2SO3 Acido SulfurOSO ICO (Mayor) H2SO4 Acido SulfurICO Cuatro números de oxidación Hipo OSO (Menor) HClO Acido Hipo clorOSO OSO (segunda) HClO2 Acido ClorOSO ICO (tercera) HClO3 Acido ClórICO
- 8. EJERCICIOS DE ACIDOS OXACIDOS Fórmulas Nombres Fórmulas Nombres H3AsO4 H3AsO3 HMnO4 HBrO3 H2SeO3 H2SeO4 H2Cr2O7 H3SbO3 H3SbO4 H3PO4 H3PO3 H2CrO4 HNO2 HNO3 HNO HClO4 HBrO HBrO2 HBrO3 HIO2 H3BO3 HIO3
- 9. LOS HIDRACIDOS Y SUS EXCEPCIONES Un hidrácido en un acido que carece de oxigeno, proviene de la unión de un NO METAL ,como los halógenos (grupo 7) y el azufre con el HIDROGENO , en estos hidrácidos el no metal trabaja con numero de oxidación negativo por tener mayor electronegatividad que el hidrógeno Son excepciones a la regla la combinación del hidrógeno con: El oxigeno, el carbono, el nitrógeno, el fosforo, el arsénico y el antimonio. H2 + Cl2 2HCl
- 10. NOMENCLATURA DE HIDRACIDOS NO METAL - HIDROGENO Acido –Nombre del no metal - HIDRICO HCl = ácido clor-HIDRICO
- 11. HIDRACIDOS Y EXCEPCIONES HCl Acido ClorHIDRICO HF Acido FluorHIDRICO HBr Acido BromHIDRICO HI Acido YodHIDRICO H2S Acido sulfHIDRICO H2O Agua CH4 Metano NH3 Amoníaco PH3 Fosfina AsH3 Arsina SbH3 Estibina
- 12. IONES Un ION es una partícula cargada eléctricamente, esta partícula puede estar formada por un elemento o un grupo de elementos ; si la carga del ión es positiva se denomina CATION, si la carga es negativa se denomina ANION. Los iones se desprenden generalmente de las bases y los ácidos Base Catión Anión Ca(OH)2 Ca⁺² (OH)¯ Acido Catión Anión HNO3 H⁺ (NO3)¯
- 15. SALES Una SAL es un compuesto que resulta de la combinación de una BASE con un ACIDO, en donde también se desprende AGUA. BASE + ACIDO SAL + AGUA NaOH + HCl NaCl + H- OH 3Ca(OH)2 + 2H3PO4 Ca3(PO4)2 + 6H2O
- 16. CUADRO PARA APLICAR EN LA NOMENCLATURA DE SALES Acido terminado en HIDRICO Sal terminada en URO HCl Acido clorhídrico NaCl Cloruro de sodio Acido terminado en OSO Sal terminada en ITO HClO2 Acido Cloroso NaClO2 Clorito de sodio Acido terminado en ICO Sal terminada en ATO H2SO4 Acido sulfúrico Na2SO4 Sulfato de sodio
- 17. NOMENCLATURA DE SALES Para nombrar las sales se utiliza los nombres tanto de los cationes como aniones que vienen derivados de las bases y ácidos. Fosfato de calcio Ca3(PO4)2
- 18. NOMBRAR ZnS CaCO3 FeSO4 K2Cr2O7 Zn(ClO4) 2 AgNO3 MgSO4 NaNO2 CuCl2 CuBrO3 KMnO4 HgCO3 AuCl3 Li2S KI NaCl Co(NO3)2 Al2(SO4)3 MnBr2 Ba3(AsO4 )2