Descripcion de la tabla periodica
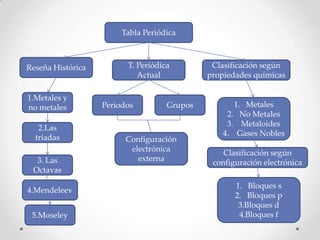
- 1. Tabla Periódica Reseña Histórica T. Periódica Clasificación según Actual propiedades químicas 1.Metales y no metales Periodos Grupos 1. Metales 2. No Metales 3. Metaloides 2.Las 4. Gases Nobles triadas Configuración electrónica Clasificación según 3. Las externa configuración electrónica Octavas 1. Bloques s 4.Mendeleev 2. Bloques p 3.Bloques d 5.Moseley 4.Bloques f
- 2. SERIES DE LA TABLA PERIÓDICA • Serie A: incluye elementos metálicos, no metálicos y gases nobles, cuya característica común es que su configuración electrónica termina en “s” o “p” • Serie B: contiene únicamente elementos metálicos, cuya característica común es que su configuración electrónica termina en “d” o “f”
- 7. BLOQUES, en base al subnivel de energía en que termina la configuración electrónica de los elementos • Bloque S: configuración electrónica, termina en “s” y todos son metales. • Bloque P: configuración electrónica, termina en “p”, existen metales, no metales y gases nobles. • Bloque D: configuración electrónica, termina en “d”, metales pesados. • Bloque F: configuración electrónica, termina en “f”, elementos llamados tierras raras.
- 8. BLOQUES
- 9. Periodos de elementos • Los Periodos de elementos son las filas (siete) horizontales de la tabla periódica. Las propiedades de los elementos varían de izquierda a derecha a lo largo de la tabla periódica. • En la izquierda, la tabla periódica inicia con unos metales muy reactivos, y en el lado derecho se ubican los no metales que terminan cada periodo con un gas noble no reactivo.
- 10. Grupos y familias • Las columnas verticales de elementos en la tabla periódica son llamadas grupos o familias. • Los elementos en el mismo grupo o familia tienen propiedades químicas similares. • Los elementos representativos pertenecen a los dos primeros grupos y los últimos seis. • Estos son designados como grupos “A” o grupos 1,2,13-18.
- 12. GRUPOS se identifican por los números romanos. • Grupo IA: metales alcalinos. • Grupo IIA: metales alcalinotérreos. • Grupo VIIA: halogenos. • Grupo VIIIA: gases nobles. • Elementos de transición – IIIB-IIB. • Elementos de transición interna – lantánidos y actínidos.
- 13. Metales, no-metales y metaloides • Metales – sustancias brillosas, opacas, buenos conductores del calor y la electricidad, maleables, dúctiles. Ejemplo: Cu. o Lado izquierdo de la tabla. • No-metales – no conducen la electricidad o calor, no maleables o dúctiles. Ejemplo; C. o Lado derecho de la tabla. • Metaloides – Elementos que tienen propiedades de ambos metales y no metales. Débiles conductores de la electricidad. Ejemplo: Si.
- 14. • Tabla periódica de los elementos, muestra la división entre metales, no-metales y metaloides.
- 17. Grupo del boro
- 21. Halógenos
- 22. Gases nobles
- 24. Grupos • Son las columnas verticales de la tabla periódica. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Numerados de izquierda a derecha utilizando números arábigos y son: Grupo 1 (I A): los metales alcalinos Grupo 2 (II A): los metales alcalinotérreos Grupo 3 (III B): Familia del Escandio Grupo 4 (IV B): Familia del Titanio Grupo 5 (V B): Familia del Vanadio Grupo 6 (VI B): Familia del Cromo Grupo 7 (VII B): Familia del Manganeso Grupo 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Grupo 8 (VIII B): Familia del Hierro Grupo 9 (IX B): Familia del Cobalto VIII VIII VIII VII VIII I A II A III B IV B V B VI B VII B I B II B III A IV A V A VI A B B B A A Grupo 10 (X B): Familia del Níquel Grupo 11 (I B): Familia del Cobre Grupo 12 (II B): Familia del Zinc Grupo 13 (III A): los térreos Grupo 14 (IV A): los carbonoideos Grupo 15 (V A): los nitrogenoideos Grupo 16 (VI A): los calcógenos o anfígenos Grupo 17 (VII A): los halógenos Grupo 18 (VIII A): los gases nobles
- 26. Períodos • Las filas horizontales de la tabla periódica son llamadas períodos. Los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. • La tabla periódica consta de 7 períodos: Período 1 Periodo Período 2 1 Período 3 2 3 Período 4 4 5 Período 5 6 7 Período 6 Período 7
- 27. Bloques o regiones • Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Bloque s Bloque p Bloque d Bloque f
- 28. Densidad • Concentración de la materia medida a través de la masa por unidad.
- 29. Radio covalente • Es la mitad de la distancia internuclear. O2: d(O-O)=1,21Å H2O2: d(O-O)=1,47 Å
- 30. Radio metálico • La mitad de la distancia internuclear entre dos átomos contiguos en el cristal es el radio metálico.
- 31. Radio iónicos Es una magnitud difícil de medir ya que, no hay una regla universal para dividir esta distancia entre los dos Iones. Radios de los cationes Los radios de los cationes son más
- 32. Energía de Ionización • Es la cantidad de energía necesaria para separar el electrón más externo de un átomo en estado fundamental, en fase gaseosa y a presión y temperatura estándar. • Son siempre valores positivos. La ionización es un proceso endotérmico. X(g) + Energía X+(g) + e−
- 33. Afinidad electrónica • Es la energía mínima necesaria para la formación de un ion uninegativo a partir el átomo neutro en su estado fundamental, en fase gaseosa y a P y T estándar X(g)+ e− X−(g) AE1
- 34. Electronegatividad • En 1931, Pauling definió la electronegatividad como la tendencia de un átomo a atraer sobre sí los electrones cuando se combina con otro formando un compuesto químico.
