Atividade de apoio para a suplementar - 2 etapa
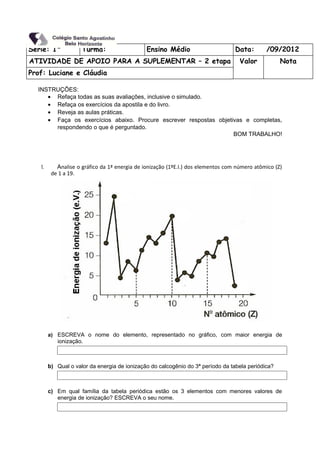
- 1. Série: 1ª Turma: Ensino Médio Data: /09/2012 ATIVIDADE DE APOIO PARA A SUPLEMENTAR – 2 etapa Valor Nota Prof: Luciane e Cláudia INSTRUÇÕES: • Refaça todas as suas avaliações, inclusive o simulado. • Refaça os exercícios da apostila e do livro. • Reveja as aulas práticas. • Faça os exercícios abaixo. Procure escrever respostas objetivas e completas, respondendo o que é perguntado. BOM TRABALHO! 1. Analise o gráfico da 1ª energia de ionização (1ºE.I.) dos elementos com número atômico (Z) de 1 a 19. a) ESCREVA o nome do elemento, representado no gráfico, com maior energia de ionização. b) Qual o valor da energia de ionização do calcogênio do 3ª período da tabela periódica? c) Em qual família da tabela periódica estão os 3 elementos com menores valores de energia de ionização? ESCREVA o seu nome.
- 2. d) EXPLIQUE por que, no intervalo de Z = 3 a Z = 10, o potencial de ionização tende a crescer com o aumento do número atômico. 2. (PUC Campinas 1993 – mod.) A água pesada, utilizada em certos tipos de reatores nucleares, é composta por dois átomos de deutério (número de massa 2) e pelo isótopo 16 de oxigênio. O número total de nêutrons na molécula da água pesada é A) 9 B) 10 C) 18 D) 20 E) 2 3. Considerando as partículas constituintes do íon Fe+ 3, pode-se afirmar que esse íon: A) Apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 3d5. B) Tem um núcleo com 23 prótons. C) Apresenta números iguais de prótons e elétrons. D) Apresenta três níveis completamente preenchidos. E) Tem um núcleo com 23 elétrons 4. Este gráfico apresenta as quatro primeiras energias de ionização de átomos de um metal pertencente ao terceiro período da tabela periódica: Com base nessas informações, é INCORRETO afirmar que os átomos desse metal apresentam A) raio atômico maior que o de qualquer dos não-metais do mesmo período. B) energia de ionização menor que a de qualquer dos não-metais do mesmo período. C) 3 níveis de energia preenchidos por elétrons. D) 3 elétrons no primeiro nível de energia.
- 3. 5. Realizou-se um experimento com um ovo cru e um copo contendo vinagre, como descrito nas figuras: Sabe-se que a casca do ovo é constituída por carbonato de cálcio (CaCO3) e que o vinagre é uma solução constituída de ácido acético. O ácido reage com o carbonato produzindo um gás. Considerando-se essas informações, é CORRETO afirmar que a) o ovo flutua porque a sua densidade diminui. b) as bolhas são formadas pela liberação de gás hidrogênio. c) ocorre uma reação de decomposição do carbonato de cálcio. d) o cheiro do vinagre diminui durante o experimento. 6. Leia o texto: DIAGNÓSTICOS COM RAIOS-X Não existe provavelmente nenhuma pessoa que não tenha feito diversos diagnósticos com raios-X dos seus dentes ou de outras partes do seu corpo. A radiação dos raios-X é um membro da família eletromagnética que inclui todos os tipos de radiação. O raio-X é produzido quando um elétron, movendo-se em alta velocidade, é desacelerado. Estes raios são resultados de colisões dos elétrons com uma superfície dura – o ânodo, dentro de um espaço evacuado. Já que a quantidade de calor produzida quando os elétrons são freados é grande, o ânodo é construído com material com propriedades adequadas e fica girando (ânodo girante) para evitar o seu superaquecimento. Figura 1. Principais componentes Os raios-X não são absorvidos igualmente por todos os de uma unidade moderna de Raios materiais; se eles fossem, eles não seriam muito úteis em diagnósticos. Elementos “pesados”, tal como o cálcio, são muito mais absorvedores de raios-X do que os elementos “leves”. Como resultado, estruturas contendo elementos “pesados” sobressaem claramente numa chapa de raios-X, depois de revelada. Texto e figuras adaptadas de http://www.lui-bertolo.hpg.ig.com.br/Raio_X/RAIO_X.HTM
- 4. Considerando-se o texto e outros conhecimentos, é INCORRETO afirmar que A) o ânodo deve ser constituído por um material com alta temperatura de fusão e com densidade elevada. B) o texto apresenta um termo inadequado para descrever as características dos materiais absorvedores de raio-X. C) a produção de raio-X envolve fenômenos nucleares que ocorrem no interior de um tubo a baixa pressão. D) o avental de chumbo é usado como proteção para raio-X porque é um metal com alta densidade e grande maleabilidade. 7. O teste de chama é uma técnica utilizada para a identificação de certos átomos ou Nome Fórmula Cor da chama íons presentes em substâncias. No quadro, Ácido clorídrico Não se observa cor há os resultados de testes de chama, HC Cloreto de cálcio Vermelho-tijolo CaC2 Cloreto de bário Verde-amarelado BaC2 Carbonato de Vermelho SrCO3 estrôncio Sulfato de sódio Na2SO4 Laranja realizados num laboratório, com quatro substâncias. Com exceção do ácido clorídrico, todas as substâncias do quadro são formadas por cátions de elementos metálicos e ânions de elementos não-metálicos. Os cátions de elementos alcalinos terrosos são bivalentes e os ânions dos halogênios são monovalentes. a) Qual a cor que seria observada no teste de chama com uma amostra do contraste radiológico contaminado? b) Qual é a quantidade de elétrons do ânion que forma a substância cloreto de cálcio? c) Qual é a distribuição eletrônica por subnível de energia do cátion que forma a substância carbonato de estrôncio? Considere o íon no estado fundamental.
- 5. d) Elabore um modelo, com legenda, que explique, em termos atômico, a emissão de luz no teste de chama. Atenção: não serão aceitos textos explicativos extensos na legenda ou no modelo. LEGENDA: 8. Analise as ilustrações, onde as setas correspondem à trajetória das partículas alfas, ao incidirem em um único átomo (observação: nas ilustrações para os átomos, não foi indicada a (1) (2) (3) (4) presença ou ausência de cargas elétricas). Considerando os conhecimentos sobre modelos atômicos, é INCORRETO afirmar que a ilustração
- 6. A) 1 representa os resultados obtidos com um átomo de ouro segundo o modelo de Thomson. B) 2 representa os resultados obtidos com um átomo de ouro segundo o modelo de Bohr. C) 3 representa os resultados obtidos com um átomo de alumínio segundo o modelo de Rutheford . D) 4 representa os resultados obtidos com um átomo de alumínio segundo o modelo de Dalton. 9. O esquema a seguir mostra o tradicional alambique usado para a preparação de bebidas alcoólicas provenientes da fermentação de açúcares e cereais. a) Qual o nome do processo de separação de misturas, representado na figura, utilizado para a produção de bebidas alcoólicas? a) Qual a finalidade, dentro do processo de fabricação de bebidas, da parte do alambique que contém água? a) Cite dois materiais de laboratório que podem substituir a parte do alambique que contém a solução e a água. Parte do alambique que contém Material de laboratório
- 7. água a solução 10. O fluxograma representado indica o processo de separação da mistura de água, óleo, areia e sulfato de cobre II (azul). Sabe-se que o sulfato de cobre não é solúvel em óleo e está completamente dissolvido na água. Com base nessas informações e nos conhecimentos sobre misturas, é CORRETO afirmar que a) a solução C corresponde a um líquido colorido. b) o gráfico de aquecimento do sistema B apresenta patamar. c) os processos I, II e III são, respectivamente, filtração, destilação e decantação. d) o sólido A possui temperatura de fusão e ebulição constantes. 11. Indique o número de: • Átomos • Elementos • Moléculas
- 8. • Substâncias simples • Substâncias compostas 12. Os processos de separação de misturas envolvem muitas propriedades específicas dos materiais. É através destas propriedades que escolhemos o processo mais adequado a cada mistura. Para resolver o exercício abaixo, utilize os dados referentes às propriedades dos materiais que compõem a mistura. Monte um fluxograma, indicando todas as etapas e processos, para separar a seguinte mistura: SISTEMA X: Enxofre, limalha de ferro, iodo, sal, óxido de magnésio. Propriedades dos materiais: a) Enxofre: sólido amarelo (pó muito fino), insolúvel em água e álcool, solúvel em dissulfeto de carbono (imiscível com os solventes anteriores), TF = 119,0 oC, TE = 444,6 oC, d = 2,07 g/mL. b) Ferro: sólido cinza metálico, insolúvel em qualquer solvente, TF = 1536,0 oC, TE = 3000,0 oC, d = 7,86 g/ml. c) Iodo: sólido cinza escuro com brilho metálico sublima quando aquecido, insolúvel em água e solúvel em álcool, d = 4,94 g/mL. d) Sal: sólido branco, solúvel em água, TF = 801,0 oC, TE = 1423 oC, d = 2,6 g/mL. e) Óxido de magnésio: sólido branco, insolúvel em água e em álcool, TF = 1852,0 oC, TE = 3600 oC. OBSERVAÇÔES IMPORTANTES: Somente o enxofre é solúvel no dissulfeto de carbono. Não é permitido separar a mistura por fusão fracionada. Os solventes utilizados devem ser recuperados no final.