Estructura proteínas
- 1. ESTRUCTURA DE LAS PROTEINAS
- 2. ¿QUÉ SON LAS PROTEÍNAS? polímeros lineales construídos a partir de monómeros llamados aminoácidos, que bajo condiciones fisiológicas tienen una estructuratridimensional definida. • Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (Creighton 2000)
- 3. Proteínas Las proteínas son los compuestos químicos más importante para la función celular • Participan en todas las funciones biológicas • Están constituidas por aminoácidos.
- 4. Diversidad funcional e importancia • Las enzimas, catalizadores de las reacciones químicas en los organismos vivientes; • Las hormonas, reguladores de actividades celulares • La hemoglobina y otras moléculas con funciones de transporte en la sangre; • Los anticuerpos responsables de acciones de defensa natural contra infecciones o agentes extraños, etc.
- 7. CATALIZADORES BIOLÓGICOS Aumente la rapidez o velocidad de una reacción química o sea, la velocidad de formación del producto. ENZIMAS
- 8. • Los AMINOÁCIDOS son los precursores moleculares de las proteínas y tienen una estructura común. (Voet, 2004) (Creighton 2000)
- 9. Estructura básica de un aminoácido
- 10. Carbono α: Centro quiral • Ópticamente activos: Porque pueden rotar la luz polarizada en un plano. ACTIVIDAD OPTICA: poseen una asimetría tal que no pueden superponerse sobre su imagen en el espejo. • L ó D • Las proteínas contienen aminoácidos de tipo L. (Voet, 2004)
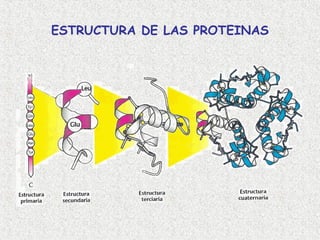
- 17. ESTRUCTURA PRIMARIA: FORMACIÓN DE UN ENLACE PEPTÍDICO Una cadena polipeptídica consiste en una cadena lineal de aminoácidos unidos por enlaces peptídicos. (Creighton 2000)
- 19. ESTRUCTURA SECUNDARIA Se refiere al ordenamiento espacial de los aminoácidos que se encuentran cerca en la secuencia. Los aminoácidos, a medida que van siendo enlazados durante la sintesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, la estructura secundaria (Creighton 2000)
- 20. • α- hélice: Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue. (Creighton 2000; Voet, 2004)
- 21. Los aminoácidos forman una cadena en forma de zigzag, denominada disposición en lámina plegada. • Forma-β (Creighton 2000; Voet, 2004)
- 22. ESTRUCTURA TERCIARIA Es su disposición espacial; es decir, el plegamiento de los elementos estructurales secundarios, junto con las disposiciones espaciales de sus cadenas, esto es, el arreglo tridimensional de todos los aminoácidos)
- 23. La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular. Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R.
- 24. ESTRUCTURA CUATERNARIA Las cadenas polipeptídicas se pueden ensamblar en estructuras de múltiples subunidades. (se presenta en proteínas que contienen más de una cadena polipeptídica, conocidas como subunidades) (Creighton 2000)
- 25. La FUNCIÓN de una proteínas es directamente dependiente de su estructura tridimensional. Por lo tanto, LA ESTRUCTURA DICTA LA FUNCIÓN Determina la especificidad de interacción con otras moléculas, Determina su función, Determina su estabilidad y tiempo de vida media
- 26. DESNATURALIZACIÓN • Consiste en la pérdida de la estructura terciaria, por romperse los puentes que forman dicha estructura. • La mayoría de las proteínas biológicas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al sitio activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo. (Cueto et all., 2007)
- 27. Los agentes que provocan la desnaturalización de una proteína se llaman agentes desnaturalizantes. 1. la polaridad del disolvente, 2. la fuerza iónica, 3. el pH, 4. la temperatura. (Cueto et all., 2007) Desnaturalización de la estructura trimimensional con urea y reducción de puentes disulfuro con 2-mercaptoetanol.
- 28. •La polaridad del disolvente: La polaridad del disolvente disminuye cuando se le añaden sustancias menos polares que el agua como el etanol o la acetona. Con ello disminuye el grado de hidratación de los grupos iónicos superficiales de la molécula proteica,provocando la agregación y precipitación. •Aumento de la fuerza iónica del medio: (por adición de sulfato amónico o urea, por ejemplo) provoca una disminución en el grado de hidratación de los grupos iónicos superficiales de la proteína, ya que estos solutos (1) compiten por el agua y (2) rompen los puentes de hidrógeno o las interacciones electrostáticas, de forma que las moléculas proteicas se agregan y precipitan. (Cueto et all., 2007)
- 29. •Efecto del ph: Los iones H+ y OH- del agua afectan a la carga eléctrica de los grupos ácidos y básicos de las cadenas laterales de los aminoácidos. Esta alteración de la carga superficial de las proteínas elimina las interacciones electrostáticas que estabilizan la estructura terciaria y a menudo provoca su precipitación. •Efecto de la temperatura: Cuando la temperatura es elevada aumenta la energía cinética de las moléculas con lo que se desorganiza la envoltura acuosa de las proteínas, y se desnaturalizan. Asimismo, un aumento de la temperatura destruye las interacciones débiles y desorganiza la estructura de la proteína, de forma que el interior hidrofóbico interacciona con el medio acuoso y se produce la agregación y precipitación de la proteína desnaturalizada. (Cueto et all., 2007)
